-
海水中含有极为丰富的自然资源。很多常见的金属元素和非金属元素主要以简单离子的形式存在于海水中,海水呈弱碱性。回答下列问题:
海水提溴过程一般分三步,①向浓缩的海水中通入Cl2,将其中的Br-氧化,2Br-+Cl2=Br2+2Cl-,再用热空气吹出溴;②然后用饱和碳酸钠溶液吸收溴,溴歧化为NaBr、NaBrO3,③最后用硫酸酸化5NaBr+NaBrO3+3H2SO4=3Na2SO4+3Br2+3H2O
(1)写出第②步反应的离子方程式 ________ ;
(2)海水浓缩后还要进一步处理才能通入Cl2,处理的方法是________ ,目的是________ ,步骤③用硫酸而不用盐酸酸化的原因可能是________ ;
(3)为了除去工业Br2中微量的Cl2,可向工业Br2中 ________;
a.通入HBr b.加入Na2CO3溶液 c.加入NaBr溶液 d.加入Na2SO3溶液
(4)海水制溴的原理体现了化学工业中“富集”“放大”思想。以海水为原料制备金属镁分三步,试写出其反应原理(用化学方程式表示)
________ , ________ , ________。
高三化学填空题中等难度题查看答案及解析
-
(8分)海水中不仅含有丰富的非金属元素资源,(如Cl,Br,I等),还含有丰富的金属元素资源(如Na,Mg,Fe,Cr等),
(1)海水晒盐的原理是: ;与Na,Cl同周期,且简单离子半径最小的离子结构示意图: (2)晒出的粗盐常混有MgSO4,CaSO4等杂质,为了得到精制盐,则提纯过程操作步骤和加入试剂的顺序是: ;(填序号)
①加稀HCl滤液至酸性,②过滤除去杂质,③加过量NaOH溶液,④加过量Na2CO3溶液⑤加过量BaCl2溶液⑥溶解,⑦蒸发结晶;
(3)晒盐得到的母液(盐卤)中含有丰富的镁元素,但其中常混有Fe2+,Cr3+等,为富集镁使其转化力MgCl2晶体。
有关资料:
M(OH)n
pH
开始沉淀
沉淀完全
Fe(OH)2
7.6
9.6
Fe(OH)3
2.7
3.7
Mg(OH)2
9.5
11.0
Cr(OH)3
4.3
5.0
为了有效除去杂质离子,又不引入新的杂质离子,且能满足“绿色化学理念”,
则最佳试剂选择和操作是:
①先加 ;目的是 ;
②再加 ;目的是 ;
③过滤后,为能得到纯净Mg Cl2晶体,采用的操作方法是: ;
高三化学填空题困难题查看答案及解析
-
短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是常见的非金属元素,主要以钠盐的形式存在于海水中。
(1)Y在元素周期表中的位置是________;X氢化物的电子式为_________。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈_______(填“酸”、“碱”或“中”)性,用离子方程式表示其原因是________。
(3)Y-Ag2O电池是应用广泛的鱼雷电池,其原理如下图所示。

该电池的负极反应式是________。
(4)Z和W比较,非金属性较弱的是________(填元素符号),下列可以验证这一结论的是_________
(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1mol H—Z或H—W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
高三化学填空题困难题查看答案及解析
-
海水中含有丰富的化学元素,下面是某化工厂从海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及综合利用的生产流程简图(如图1):
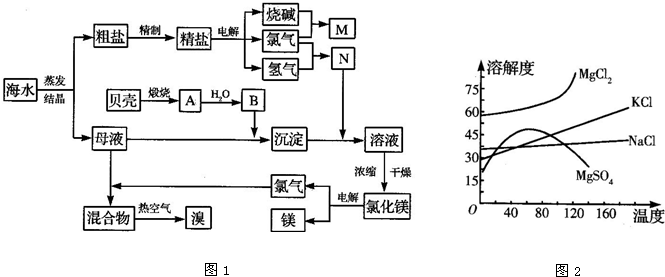
请回答下列问题:
(1)向Mg(OH)2中加入盐酸后,要获得MgCl2•6H2O晶体,需要进行的实验操作依次为______(填序号).
A.蒸馏 B.灼烧 C.过滤
D.蒸发 E.冷却结晶
(2)目前工业上主要采用隔膜法电解饱和食盐水,下列关于隔膜电解槽的叙述错误的是______(填序号).
A.隔膜的作用,防止氯气和氢氧化钠、氯气和氢气接触而发生反应
B.电解之前应除去Ca、Mg,以防止电解时生成Ca(OH)2、Mg(OH)2,从而堵塞隔膜
C.阴极产物为氢氧化钠和氢气
D.电解槽的阳极用金属铁网制成
(3)母液中常含有MgCl2、NaCl、MgSO4、KCl等(其溶解度曲线如图2所示),可进一步加工制得一些重要的产品.若将母液加热升温到60℃以上,随着水分的蒸发,会逐渐析出晶体,此晶体的主要成分是______;过滤上述晶体后,将滤液降温到30℃以下,又逐渐析出晶体,用一定量的冷水洗涤该晶体,最后可得到比较纯净的______晶体.高三化学解答题中等难度题查看答案及解析
-
A、B、C、X是中学化学中常见的4种物质,它们均由短周期元素组成,转化关系如图所示。请针对以下三种情况回答下列问题。
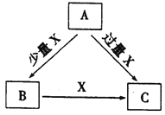
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得白色胶状沉淀B。
①A中含有的金属元素为__________(填元素名称)
② 该金属元素的单质与某氧化物在高温下反应,可用于焊接铁轨及定向爆破,反应的化学反应方程式是_______________
(2)若A为固态非金属单质,A与X同周期,常温常压下C 为 白色固体,B分子中各原子最外层均为8电子结构。
① B的电子式为_____________。
② C与水剧烈反应,生成两种常见酸,反应的化学方程式为___________________。
(3) 若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
① A中所含有的化学键是_____________。
② 自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为__________g。
高三化学填空题中等难度题查看答案及解析
-
A、B、C、X是中学化学中常见的4种物质,它们均由短周期元素组成,转化关系如图所示。请针对以下两种情况回答下列问题。

(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,将A、C的水溶液混合可得白色胶状沉淀B。
① A中含有的金属元素为__________(填元素名称)。
②该金属元素的单质与某氧化物在高温下反应,可用于焊接铁轨,此反应的化学方程式为:__________。
(2)若A、B、C的焰色反应均呈黄色,水溶液均呈碱性。
① A中所含有的化学键是________、__________。
②将4.48 L(标准状况下)X通入100 mL3 mol/LA的水溶液后,溶液中离子浓度由大到小的顺序为__________。
③自然界中存在由B或C与H2O按一定比例结晶而成的固体。将一定置的由C与H2O按一定比例形成的晶体溶于水配制成100 mL溶液,测得溶液中金属阳离子的浓度为0.5mol/L。若取相同质量的此晶体加热至恒重,剩余固体的质量为________________。
高三化学推断题困难题查看答案及解析
-
A、B、C、X是中学化学1中常见的4种物质,它们均由短周期元素组成,转化关系如图所示.请针对以下两种情况1回答下列问题:
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在.将A、C的水溶液混合可得白色胶状沉淀B.
①A中含有的金属元素为______(填元素名称).
②该金属元素的单质与某氧化物在高温下反应,可用于焊接铁轨及定向爆破,此反应的化学方程式为______ Al2O3+2Fe
高三化学解答题中等难度题查看答案及解析
-
A、B、C、X是中学化学常见化合物或单质,均由短周期元素组成,转化关系如图。请据图回答下列问题:
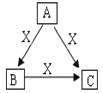
(1)若A、B、C中均含同一种常见金属元素R,R在C中以阴离子形式存在,B为白色胶状沉淀。
①R在元素周期表中的位置为______________。
②若A的溶液中混有Fe3+,当向该混合液中加入氨水,生成R(OH)n及Fe(OH)3共沉淀时,溶液中c(Fe3+)/ c(Rn+)=____。[已知:Fe(OH)3的 Ksp=4.00×10-38,沉淀B的Ksp=1.32×10-33 ]
(2)若A、B、C的焰色反应均为黄色,水溶液均呈碱性。
①A中含有的化学键是________________________。
②将672 mL(标准状况下)X通入100 mL 0.4mol·L- 1 A的溶液后,溶液中离子浓度由大到小的顺序为_______________________。
③自然界中存在B、C和H2O按一定比例形成的固体。取一定量该固体制成100mL溶液,测得溶液中金属阳离子的浓度为0.5mol·L-1。若取相同质量的固体加热至恒重,剩余固体的质量为_______。
(3)若A、B、C中均含同一种常见非金属元素,其中A为黑色固体单质。已知298K下,1mol A、1 mol B完全燃烧生成稳定氧化物放出的热量分别为393.5 kJ,283 kJ。写出该温度下A与C反应生成B的热化学方程式:______________________。
高三化学综合题困难题查看答案及解析
-
(10分)海藻中含有丰富的、以离子形式存在的碘元素.如图是实验室从海藻里提取碘的流程的一部分。

回答下列问题:
(1)步骤①、③的操作分别是 。
(2)步骤②的离子反应方程式: 。步骤②中Cl2应 (填少量或适量或过量)。
(3)在步骤②中若不用Cl2,则下列氧化剂中最好选用(填代号): 。
A.浓硫酸 B.新制氯水 C.高锰酸钾溶液 D.双氧水
(4)步骤③中应加入的有机溶剂是 ,而不能用 等有机溶剂。
(5)能否用淀粉溶液检验步骤②的反应有否进行完全 (填能或否),其理由是: 。
高三化学填空题中等难度题查看答案及解析
-
研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
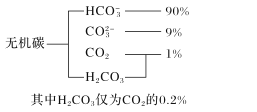
(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因______________________。已知春季海水pH=8.1,预测冬季海水碱性将会_______(填“增强”或“减弱”),理由是_________________。
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)===CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是________(填字母)。
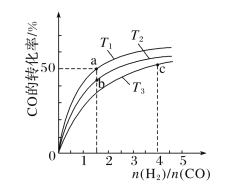
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:
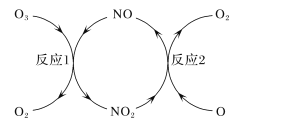
①NO的作用是_________________。
②已知:O3(g)+O(g)===2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)===NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1 。
反应2:热化学方程式为____________________________。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol -1,反应达到平衡时,N的体积分数随n(CO)n(NO)的变化曲线如下图。
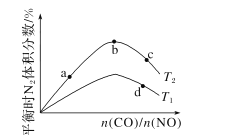
①b点时,平衡体系中C、N原子个数之比接近________。
②a、b、c三点CO的转化率从小到大的顺序为________;b、c、d三点的平衡常数从大到小的顺序为__________。
③若n(CO)n(NO)=0.8,反应达平衡时,N的体积分数为20%,则NO的转化率为_____。
高三化学综合题困难题查看答案及解析