-
一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8mol NO2,发生如下反应:2NO2(红棕色)⇌N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:
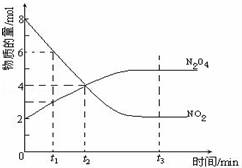
(1)在该温度下,反应的化学平衡常数表达式为:
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol•L﹣1•s﹣1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率.
-
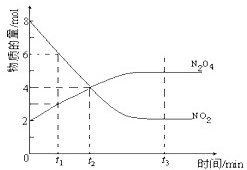
一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8mol NO2,发生如下反应:2NO2(红棕色)⇌N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为:________
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率:________mol•L-1•s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:________
(4)t1时,正反应速率________(填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向________ 移动 (填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色________(填“变深”、“变浅”或“不变”)
-
一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8mol NO2,发生如下反应:2NO2(红棕色)⇌N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如图,按下列要求作答:
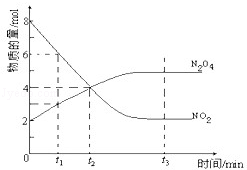
(1)在该温度下,反应的化学平衡常数表达式为:
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: mol•L﹣1•s﹣1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:
(4)t1时,正反应速率 (填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动(填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色 (填“变深”、“变浅”或“不变”)
-
8分)一定温度下,在容积为1L的密闭容器内放入2mol N2O4和8 mol NO2,发生如下反应:2NO2(红棕色) N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
N2O4(无色)(△H<0),反应中NO2、N2O4的物质的量随反应时间变化的曲线如下图,按下列要求作答:
(1)在该温度下,反应的化学平衡常数表达式为:________
(2)若t1=10s,t2=20s,计算从t1至t2时以N2O4表示的反应速率: ________mol·L-1·s-1
(3)图中t1、t2、t3哪一个时刻表示反应已经达到平衡?答:
(4)t1时,正反应速率 ________ (填“>”、“<”或“=”)逆反应速率
(5)维持容器的温度不变,若缩小容器的体积,则平衡向 移动
(填“正反应方向”、“逆反应方向”或“不移动”)
(6)维持容器的体积不变,升高温度,达到新平衡时体系的颜色 ________ ________
(填“变深”、“变浅”或“不变”)
-
在一定温度下,向容积固定不变的密闭容器中充入a mol NO2,发生如下反应:2NO2(g)⇌N2O4(g);△H<0.达平衡后再向容器中充入amol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
A.相对平均分子质量增大
B.NO2的转化率提高
C.NO2的质量分数增大
D.反应放出的总热量大于原来的2倍
-
在一定温度下,向容积固定不变的密闭容器中充入a mol NO2,发生如下反应:2NO2(g)⇌N2O4(g);△H<0.达平衡后再向容器中充入amol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
A. 相对平均分子质量增大 B. NO2的转化率提高
C. NO2的质量分数增大 D. 反应放出的总热量大于原来的2倍
-
在一定温度下,向容积固定不变的密闭容器中充入a mol NO2,发生如下反应:2NO2(g) N2O4(g);△H<0。达平衡后再向容器中充入amol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是
N2O4(g);△H<0。达平衡后再向容器中充入amol NO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是
A.相对平均分子质量增大 B.NO2的转化率提高
C.NO2的质量分数增大 D.反应放出的总热量大于原来的2倍
-
在一定温度下,向容积固定不变的密闭容器内充入a mol NO2,发生如下反应:2NO2 (g) N2O4 (g) ,则达到平衡后,再向该容器内充入a mol NO2,达新平衡后与原平衡比较不正确的是 ( )
N2O4 (g) ,则达到平衡后,再向该容器内充入a mol NO2,达新平衡后与原平衡比较不正确的是 ( )
A.平均相对分子质量增大 B.NO2的质量分数增大
C.颜色变深  D.反应放出的总热量大于原平衡的2倍
D.反应放出的总热量大于原平衡的2倍
-
在一定温度下,向容积固定不变的密闭容器里充入a mol NO2,发生如下反应:2NO2(g) N2O4(g),达到平衡后,再向该容器内充入a mol NO2,达平衡后与原平衡比较错误的是
N2O4(g),达到平衡后,再向该容器内充入a mol NO2,达平衡后与原平衡比较错误的是
A.平均相对分子质量增大 B.NO2的转化率提高
C.压强为原来的2倍 D.颜色变深
-
在一定温度下,向容积固定不变的密闭容器中充入amolNO2,发生如下反应:
2NO2(g) N2O4(g)△H<0达平衡后再向容器中充入amolNO2,再次达到平
N2O4(g)△H<0达平衡后再向容器中充入amolNO2,再次达到平 衡后,
衡后, 与原平衡比较,下列叙述不正确的是
与原平衡比较,下列叙述不正确的是
A.相对平均分子质量增大
B.NO2的转化率提高
C.NO2的质量分数增大
D.反应放出的总热量大于原来的2倍


