-
NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
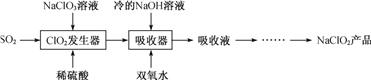
(1) ClO2发生器中发生反应的离子方程式为_________________。
(2) 吸收器中反应温度不能高于5 ℃的可能原因有____________。
(3) 查阅资料可知:
Ⅰ.ClO2能被I-还原为ClO2-或Cl-:
2ClO2+2I- 2ClO2-+I2
2ClO2-+I2
2ClO2+8H++10I- 2Cl-+5I2+4H2O
2Cl-+5I2+4H2O
ClO2的转化率与溶液pH的关系如图所示。
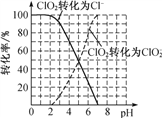
Ⅱ.pH≤2.0时,ClO2-能被I-完全还原为Cl-:ClO2-+4H++4I- Cl-+2I2+2H2O
Cl-+2I2+2H2O
取少量吸收液加水稀释至一定体积后得溶液Y,可通过下列步骤测定溶液Y中ClO2、ClO2-的浓度:
步骤1:准确量取25.00 mL溶液Y,调节溶液的pH为8.0,加入足量的KI晶体。滴入2滴淀粉溶液,滴加0.020 00 mol·L-1 Na2S2O3溶液,发生反应:2Na2S2O3+I2 Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。
步骤2:调节上述反应后溶液的pH为1.0,滴加0.250 0 mol·L-1 Na2S2O3溶液。恰好完全反应时,消耗0.250 0 mol·L-1 Na2S2O3溶液40.00 mL。
①判断Na2S2O3溶液与I2恰好完全反应时的实验现象是____________。
②请计算溶液Y中ClO2-的物质的量浓度_____________(写出计算过程)。
-
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在.某同学查阅资料后设计生产NaClO2的主要流程如下。
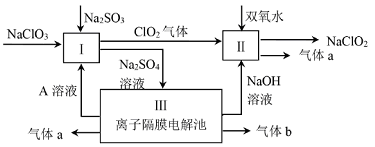
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是_________、_________(填化学式).
(2)Ⅱ中反应的离子方程式是_________;
(3)装置Ⅲ中A在_________极区产生.
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O.
①该反应中氧化剂和还原剂的物质的量之比是_________;
②研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是_________;
(5)NaClO2变质可分解为NaClO3和NaCl.取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是_________。
-
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业,工业上生产亚氯酸钠和高氯酸的工艺流程如下:

已知:NaHSO4的溶解度随温度的升高而增大,适当条件下可结晶析出。请回答下列问题:
(1)NaClO2中氯元素的化合价为_________;某饱和NaCl溶液中含有CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:①加入稍过量的Na2CO3溶液;②加入稍过量的NaOH溶液;③加入稍过量的BaCl2溶液;④滴入稀盐酸至无气泡产生;⑤过滤。正确的操作顺序是________。
(2)气体b是______(填化学式);无隔膜电解槽中阳极的电极反应式为___________。
(3)反应器I中发生反应的化学方程式为_________,冷却的目的是___________。
(4)反应器II中发生反应的离子方程式为________________。
(5)常温下,HClO2的电离平衡常数Ka=1.07×10-2,反应器II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中 =__________。
=__________。
-
ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。

下列说法不正确的是
A. 步骤a的操作包括过滤、洗涤和干燥
B. 吸收器中生成NaClO2的离子方程式:2ClO2+H2O2=2C1O2-+O2↑+2H+
C. 工业上可将ClO2制成NaClO2固体,便于贮存和运输
D. 通入空气的目的是驱赶出ClO2,使其被吸收器充分吸收
-
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。

(1)双氧水的结构式为:___________;Ⅰ中发生反应的还原剂是_____(填化学式)。
(2)Ⅱ中反应的离子方程式是_______________________________。
(3)A的化学式是________,装置Ⅲ中A在________极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。
①写出该反应的化学方程式_______。
②研究表明:若反应开始时盐酸浓度较大,则气体产物中有Cl2,用离子方程式解释产生Cl2的原因_______________________________。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量_______(填相同、不相同或无法判断)
-
亚氯酸钠(NaClO2)主要用于棉纺、造纸业的漂白剂,也用于食品消毒、水处理等,亚氯酸钠受热易分解。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下:
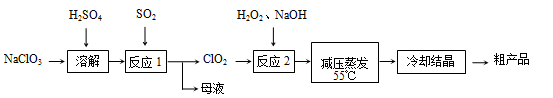
(1)“反应2”的还原剂是____________,写出它的电子式 ,该反应的化学方程式为 ,原因是___________________。
(3)从“母液”中可回收的主要物质是 。
(4)“冷却结晶”后经___________(填操作名称)即可获得粗产品。
-
(11分)高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,且不会造成二次污染。已知高铁酸盐热稳定性差,工业上用湿法制备高铁酸钾的基本流程如下图所示:
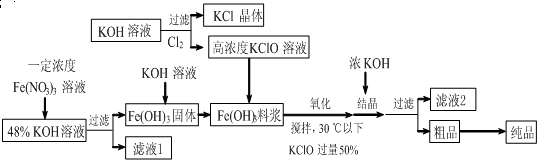
(1)上述氧化过程中,发生反应的离子方程式是:,控制反应温度30℃以下的原因是:。
(2)结晶过程中加入浓KOH溶液的作用是:。
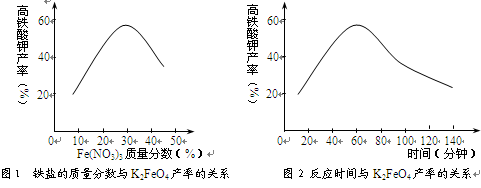
(3)根据图1、图2回答:为了获取更多的高铁酸钾,铁盐的质量分数应控制在________附近、反应时间应控制在________。
-
【化学选修2:化学与技术】(15分)工业上生产高氯酸时,还同时生产了一种常见的重要含氯消毒剂和漂白剂亚氯酸钠(NaClO2),其工艺流程如下:
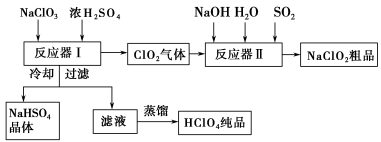
已知:①NaHSO4溶解度随温度的升高而增大,适当 条件下可结晶析出。
②高氯酸是至今为止人们已知酸中的最强酸,沸点90 ℃。
请回答下列问题:
反应器Ⅰ中发生反应的化学方程式为 ,冷却的目的是 ,能用蒸馏法分离出高氯酸的原因是 。
(2)反应器Ⅱ中发生反应的离子方程式为 。
(3)通入反应器Ⅱ中的SO2用H2O2代替同样能生成NaClO2,请简要说明双氧水在反应中能代替SO2的原因是 。
(4)Ca(ClO)2、ClO2、NaClO2等含氯化合物都是常用的消毒剂和漂白剂,是因为它们都具有 ,请写出工业上用氯气和NaOH溶液生产消毒剂NaClO的离子方程式: 。
-
一种利用铝土矿(含有氧化铝和杂质)生产氧化铝纯品的工业流程如下:
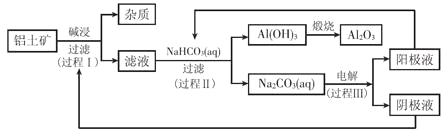
(1)过程I,发生反应的离子方程式是________________。
(2)过程II,用一定浓度的NaHCO3溶液处理碱浸后滤液,所得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:
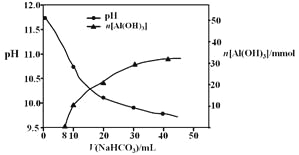
① 加入NaHCO3溶液体积小于8 mL时,发生主要反应的离子方程式是________________。
② 过程II生成Al(OH)3的离子方程式是_____________。
(3)过程III,电解Na2CO3溶液的装置如下图所示。
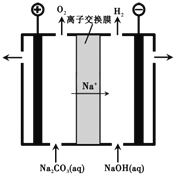
① 阴极的电极反应式是________________。
② 简述阳极液生成的原理:______________。
-
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖的漂白和杀菌,其一种生产工艺流程如下:
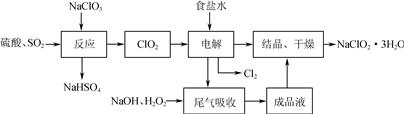
回答下列问题:
(1) 写出“反应”步骤中生成ClO2的化学方程式:________________________。
(2) “电解”所用食盐水由粗盐水精制而成,精制时为除去Mg2+和Ca2+,要加入的试剂分别为___________________、___________________。
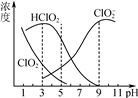
(3) 亚氯酸钠(NaClO2)在水溶液中可生成ClO2、HClO2、ClO 、Cl-等,其中HClO2和ClO2都具有漂白作用。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则使用该漂白剂的适宜pH________(填“大于”“ 等于”或“小于”)3。
、Cl-等,其中HClO2和ClO2都具有漂白作用。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则使用该漂白剂的适宜pH________(填“大于”“ 等于”或“小于”)3。
(4) 为了测定NaClO2·3H2O的纯度,取上述合成产品10.00 g溶于水配成1000 mL溶液,取出20.00 mL溶液于锥形瓶中,再加入足量硫酸酸化的KI溶液,充分反应后加入2~3滴淀粉溶液,用0.2640 mol·L-1Na2S2O3标准溶液滴定,共用去Na2S2O3标准溶液20.00 mL,通过计算确定该产品纯度是否合格?(合格纯度在90%以上)(写出计算过程)__________
提示: 2Na2S2O3+I2===Na2S4O6+2NaI。

2ClO2-+I2
2Cl-+5I2+4H2O

Cl-+2I2+2H2O
Na2S4O6+2NaI。恰好完全反应时,消耗0.020 00 mol·L-1Na2S2O3溶液12.50 mL。












