-
亚硝酰氯(NOCl)可用于合成清洁剂,可由氯气与一氧化氮在常温常压下合成。熔点:-64.5℃,沸点:-5.5℃;常温下是黄色的有毒气体,遇水易水解。已知NO不与NaOH溶液反应。请按要求回答下列问题。
(1)过量铁屑和稀硝酸充分反应制备NO的离子方程式为_____________。其他条件相同,选用铁片比铜片制备NO的优点是_______________。
(2)制备NOCl的装置如下图所示,连接顺序为a→_______________(按气流自左向右方向,用小写字母表示)
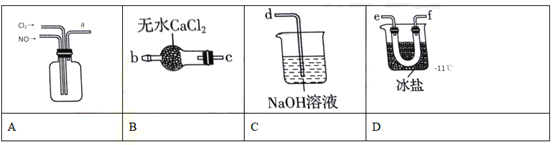
①装置A中反应的化学方程式:_______________。NOCl分子中各原子均满足8电子稳定结构,则它的电子式为_______________。
②若实验中没有安装装置B,其后果是_______________。
③实验开始应先在装置中通入Cl2,至装置A中充满黄绿色气体时,再将NO缓缓通入,此操作的目的是_______________。
(3)工业生产过程中NO尾气处理方法有多种,其中间接电化学法,其原理如图所示:
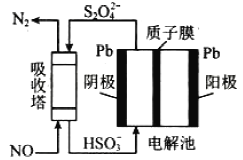
①吸收塔内发生的反应为_______________。
②阴极的电极反应式为_______________。
-
亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。制备装置如下图所示:(其中Ⅲ、Ⅳ、Ⅴ中都为浓硫酸)
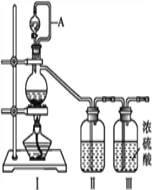
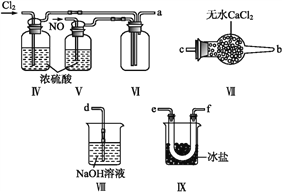
(1)用同一装置Ⅰ、Ⅱ、III分别制备纯净干燥的NO和Cl2,下表中缺少的药品是:
| 装置Ⅰ | 装置Ⅱ |
| 烧瓶中 | 分液漏斗中 |
| 制备纯净Cl2 | MnO2 | 浓盐酸 | ①___ |
| 制备纯净NO | Cu | ②___ | 水 |
(2)A的作用____________________________。
(3)NOCl的电子式_________。
(4)利用制得的NO和Cl2制备NOCl,方程式:2NO + Cl2 = 2NOCl;装置如上图所示:
①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅷ中吸收尾气时,Cl2发生反应的离子方程式为________________。
(5)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气,该反应的化学方程式为__________________。
-
亚硝酰氯(NOCl)是一种黄色气体,熔点为-64.5 ℃,沸点为-5.5 ℃,遇水易水解,可用于合成清洁剂、触媒剂等。实验室可由氯气与一氧化氮在常温常压下制备亚硝酰氯。某同学利用纯净的NO和Cl2制备NOCl,装置如下图所示。(已知:Cl2的熔点为-101 ℃,沸点为-34 ℃;NO的熔点为-163.6 ℃,沸点为-151 ℃)
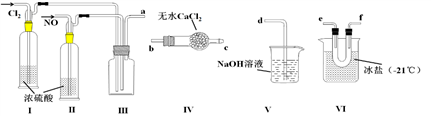
(1)装置连接顺序为a→_______________________(按气流方向,用小写字母表示)。
(2)装置I和II除可进一步干燥NO和Cl2外,另一个作用是____________________。
(3)装置IV的作用是_________________________________,当使用该装置干燥气体时,通常
是b口进气,c口出气,原因是__________________________________。
(4)装置V中吸收尾气时,NOCl发生反应的化学方程式为_________________________。
(5)在实际实验操作中,Cl2和NO通入比例略大于1:2,这样做的原因是_________________。
(6)已知王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和一种常见有色气体,该反应的化学方程式为____________________________。
-
亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
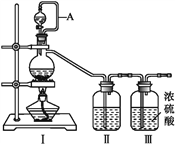
为制备纯净干燥的气体,下表中缺少的药品是:
| 装置Ⅰ | 装置Ⅱ |
| 烧瓶中 | 分液漏斗中 |
| 制备纯净Cl2 | MnO2 | ①___ | ②___ |
| 制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
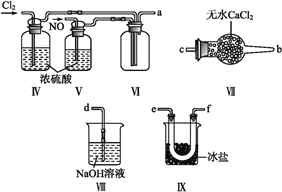
①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。
-
亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:
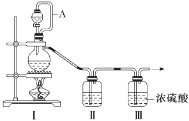
为制备纯净干燥的气体,补充下表中缺少的药品。
| 装置Ⅰ | 装置Ⅱ |
| 烧瓶中 | 分液漏斗中 |
| 制备纯净的Cl2 | MnO2 | ①________ | ②________ |
| 制备纯净的NO | Cu | ③________ | ④________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
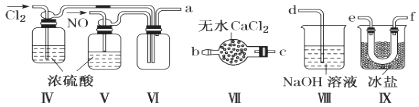
①装置连接顺序为a→________________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________________。
③装置Ⅶ的作用是________________________________________________________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为______________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为_______________________________________。
-
亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:
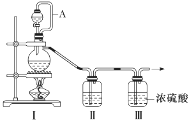
为制备纯净干燥的气体,补充下表中缺少的药品。
| 装置Ⅰ | 装置Ⅱ |
| 烧瓶中 | 分液漏斗中 |
| 制备纯净的Cl2 | MnO2 | ①________ | ②________ |
| 制备纯净的NO | Cu | ③________ | ④________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
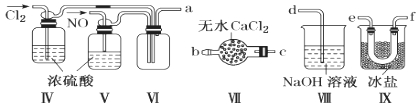
①装置连接顺序为a→________________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________________。
③装置Ⅶ的作用是________________________________________________________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为______________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为_______________________________________。
-
亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:
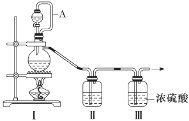
为制备纯净干燥的气体,补充下表中缺少的药品。
| 装置Ⅰ | 装置Ⅱ |
| 烧瓶中 | 分液漏斗中 |
| 制备纯净的Cl2 | MnO2 | ①________ | ②________ |
| 制备纯净的NO | Cu | ③________ | ④________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
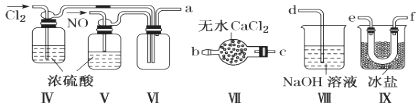
①装置连接顺序为a→________________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________________。
③装置Ⅶ的作用是________________________________________________________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为______________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为_______________________________________。
-
亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:
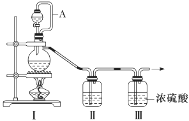
为制备纯净干燥的气体,补充下表中缺少的药品。
| 装置Ⅰ | 装置Ⅱ |
| 烧瓶中 | 分液漏斗中 |
| 制备纯净的Cl2 | MnO2 | ①________ | ②________ |
| 制备纯净的NO | Cu | ③________ | ④________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
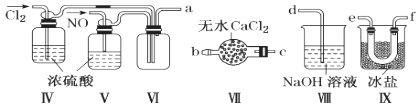
①装置连接顺序为a→________________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________________。
③装置Ⅶ的作用是________________________________________________________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为______________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为_______________________________________。
-
亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
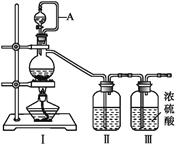
为制备纯净干燥的气体,下表中缺少的药品是:
| 装置Ⅰ | 装置Ⅱ |
| 烧瓶中 | 分液漏斗中 |
| 制备纯净Cl2 | MnO2 | ①___ | ②___ |
| 制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
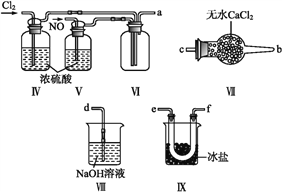
①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。
-
亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
为制备纯净干燥的气体,下表中缺少的药品是:
| 装置Ⅰ | 装置Ⅱ |
| 烧瓶中 | 分液漏斗中 |
| 制备纯净Cl2 | MnO2 | ①________ | ②________ |
| 制备纯净NO | Cu | ③________ | ④________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
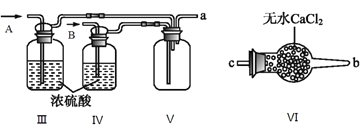
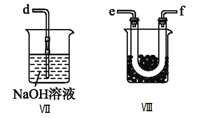
①为了使气体充分反应,从A处进入的气体是____________(填Cl2或NO)。
②装置连接顺序为a→_______________________(按气流自左向右方向,用小写字母表示)。
③装置Ⅲ、Ⅳ除可干燥NO、Cl2外,另一个作用是________________________。
④装置Ⅷ的烧杯中盛放的试剂是_____________________(填编号①水②冰水③冰盐水)
⑤装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为___________________________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为________________________________。



















