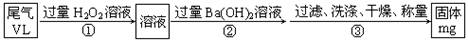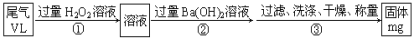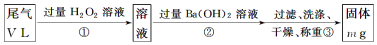-
硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
甲方案:如图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。
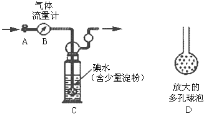
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:_________。
(2)洗气瓶C中的溶液可以酸性高锰酸钾溶液替代,请写出离子方程式:________。
(3)本实验的关键在于关闭气体流量计的时机,应当在什么时候关闭活塞A____________
乙方案:实验步骤如以下流程图所示:
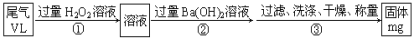
(4)写出步骤①中反应的化学方程式_________。
(5)如何判断步骤②中沉淀是否完全的方法___________。
(6)经测定当通过的尾气体积为67.2L(已换算成标准状况)时,最终得到固体质量为4.66g,则该尾气中二氧化硫含量(体积分数)为__________(保留到0.01%)
丙方案:将乙中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,其余步骤与方案乙相同。
(7)你认为丙方案________(填是或否)合理,说明理由:___________
-
(22分)硫酸工业尾气中二氧化硫含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫含量,采用以下方案:
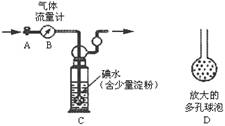
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定二氧化硫的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A,根据碘水用量可计算SO2的量,与气体流量计数据之比即可判断SO2是否超标。
(1)已知二氧化硫与碘水的反应为:________SO2+________I2+________H2O==________H2SO4+________HI,配平该反应并指出还原剂________。
(2)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验准确度,其理由是:________。
(3)洗气瓶C溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量________
(填“偏高”、“偏低”或“无影响”)。
乙方案:尾气被过氧化氢氧化后与氢氧化钡反应,实验步骤如以下流程图所示:
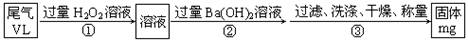
(4)写出步骤①中反应的化学方程式________。
(5)写出步骤②中反应的化学方程式________。
(6)通过的尾气体积为VL(已换算成标准状况)时,该尾气中二氧化硫含量(体积分数)为________(用含有V、m的代数式表示)。
(7)若将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液,其余步骤与方案乙相同,你认为这样处理是否合理________,说明理由:________。
-
(6分)硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
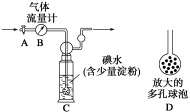
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是_________________。
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量 (填“偏高”、“偏低”或“无影响”)。
乙方案:实验步骤如图所示:
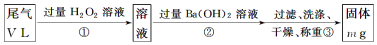
(3)步骤③中洗涤沉淀的方法是___________________________________________。
(4)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为 (用含有V、m的代数式表示)。如果将双氧水换成足量用稀硫酸酸化的高锰酸钾溶液,方案是否合理 ,如不合理,如何改进 (认为合理可不填)。
-
某兴趣小组利用下图装置测定某硫酸工厂排放尾气中二氧化硫的含量,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积的碘水,并通过实验测定SO2的含量。当洗气瓶C中溶液蓝色刚好消失时,立即关闭活塞A。
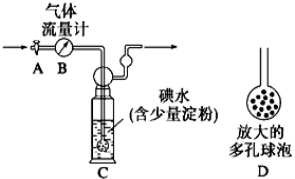
(1) C中导管末端连接一个多孔球泡D,其作用是 ,可以提高实验的准确度。
(2) C中发生反应为SO2 + I2 +2H2O = H2SO4+ 2HI , I2 是 (氧化剂、还原剂)。
(3) 某同学根据反应:SO2 +2FeCl3+2H2O = H2SO4+2FeCl2+2HCl,设计了一个实验,比较SO2与Fe2+ 还 原性的强弱:取少量C中溶液于试管中,滴加2mL氯化铁溶液,摇匀,滴入几滴KSCN溶液,溶液不变红色 , (试剂任选,请完善步骤、现象和结论)。
(4) ① 当流量计B中刚好通过2L尾气时,C中溶液蓝色刚好消失,立即关闭活塞A,容器C中恰好得到100mL溶液,将该溶液全部转移至锥形瓶中,滴入过量BaCl2溶液,过滤、洗涤、干燥,得到4.66g 白色沉淀,通过计算可知,上述尾气中二氧化硫的含量为 g/L。 (相对原子质量: Ba-137 S-32 O-16)
② 若洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量 (填“偏高”、“偏低”或“无影响”).
-
工业制硫酸吸收塔排出的尾气需要处理才能排放到大气中,其处理方法为:先用氨水吸收,再用浓硫酸处理,得到较高浓度的SO2和铵盐。
为测定该铵盐中氮元素的质量分数,将不同质量的铵盐分别加入到50.00mL相同浓度的NaOH溶液中,沸水浴加热至气体全部逸出(此温度下铵盐不分解)。该气体经干燥后用浓硫酸吸收完全,测定浓硫酸增加的质量。
部分测定结果:
铵盐质量为10.00g和20.00g 时,浓硫酸增加的质量相同;铵盐质量为30.00g时,浓硫酸增加的质量为0.68g;铵盐质量为40.00g时,浓硫酸的质量不变。
请计算:
(1)该铵盐中氮元素的质量分数是____%。
(2)若铵盐质量为15.00g,浓硫酸增加的质量为____。(计算结果保留两位小数)
-
(8分)接触法制硫酸排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前设法进行综合利用。某硫酸厂每天排放的1万米3(已换算成标准状况)尾气中含0.2%(体积百分数)的SO2。
(1)若用生石灰及氧气处理后,假设硫元素不损失,理论上可得到多少千克生石膏?
(2)若用氨水处理,最少需要标况下的氨气多少升?最多需要标准状况下的氨气多少升?
-
形成酸雨的主要原因是( )
A.未经处理的工业废水任意排放
B.大气中二氧化碳含量增多
C.工业上大量燃烧含硫燃料和以含硫矿石为原料冶炼金属
D.汽车排放尾气
-
形成酸雨的主要原因是( )
A.未经处理的工业废水任意排放
B.大气中二氧化碳含量增多
C.工业上大量燃烧含硫燃料和以含硫矿石为原料以的金属冶炼
D.汽车排放的尾气
-
某硫酸工厂排放的尾气中,含少量的二氧化硫。如果将一定体积的尾气通入100mL2mol/L的氢氧化钠溶液使其完全反应,经测定所得溶液含有16.7g溶质。试分析该溶液的成分,并计算确定各成分的物质的量___。
-
硝酸工业尾气中含有高浓度的NO和NO2,它们都是大气的重要污染物.已知某厂排放的尾气中NO、NO2的体积比为1:1,该厂采用NaOH溶液来处理该尾气,处理后所得溶液中只有一种含氮的钠盐.则该含氮的钠盐中,氮元素的化合价为( )
A.-3
B.+1
C.+3
D.+5