-
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增多。其中A、B、C都是能层数为2的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。E的核外电子排布中有6个未成对电子,是同周期中最多的,ECl3能与B、C的氢化物形成六配体的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界。试用相应的元素符号或式子填空:
(1)写出元素的名称 A ___________ E ____________;
(2)A、B、C的第一电离能由小到大的顺序为 __________;B的氢化物分子的空间构型为 _________ 。
(3)化合物AC2与一种由B、C组成的化合物X互为等电子体,则X的化学式为 ____________;完全由B的原子组成的某粒子与AC2也属于等电子体,该粒子的化学式为 _____ ,其空间构型为 __________ 。
(4)ECl3形成的配合物的化学式为 ____________________________ ;
(5)D的单质在AC2中可以燃烧并一种白色固体和一种黑色固体,该反应的化学方程式为 ________ 。
(6)与E同周期,且最外层电子排布相同的元素有___________。
高二化学推断题中等难度题查看答案及解析
-
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增多。其中A、B、C都是能层数为2的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。E的核外电子排布中有6个未成对电子,是同周期中最多的,ECl3能与B、C的氢化物形成六配体的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界。试用相应的元素符号或式子填空:
(1)写出元素的名称 A ___________ E ____________;
(2).A、B、C的第一电离能由小到大的顺序为 _____________________;B的氢化物分子的中心原子采取_______ 杂化;该分子的空间构型为 _______________ 。
(3)化合物AC2与一种由B、C组成的化合物X互为等电子体,则X的化学式为 ____________;完全由B的原子组成的某粒子与AC2也属于等电子体,该粒子的化学式为 ________ ,其空间构型为 ______________ 。
(4)ECl3形成的配合物的化学式为 ____________________________ ;
(5)D的单质在AC2中可以燃烧并一种白色固体和一种黑色固体,该反应的化学方程式为 ________ 。
(6)与E同周期,且最外层电子排布相同的原子的价层电子排布式有______。
高二化学简答题中等难度题查看答案及解析
-
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次递增。其中A原子核外有三个未成对电子;化合物B2E为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子最外层电子数与B的相同,其余各层均充满电子。请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F用所对应的元素符号表示):
(1)A、B、C、D四种元素第一电离能最大的是_______________。
(2)B的氯化物的熔点比D的氯化物的熔点__________(填“高”或“低”),理由是
_______________________________________________________________________________。
(3)E的低价氧化物分子的立体构型是_________________,用KMnO4酸性溶液吸收该氧化物时,MnO4-被还原为Mn2+,该反应的离子方程式为______________________________________。
(4)F的核外电子排布式是___________。
(5)A、F形成某种化合物的晶胞结构如下图所示(其中A显-3价),该化合物的化学式是_________________,若晶胞边长为a cm,阿伏伽德罗常数为NA,则该晶体的密度计算式为ρ=___________g/cm3(用含a、NA的符号表示)。
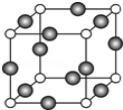
高二化学简答题困难题查看答案及解析
-
己知A、B、c、D、E都是周期表中前四周期的元素,它们的核电荷数依次增大。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氧化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24, ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)B、C、D的第一电离能由小到大的顺序为__________________。
(2)B的氢化物的分子空间构型是____________,其中心原子采取的杂化方式是________________。
(3)写出化合物AC2的电子式______________,一种由B、C组成的化合物与AC2互为等电子体,其化学式为_________。
(4)ECl3形成的配合物的化学式为______________________。
高二化学简答题困难题查看答案及解析
-
短周期元素X、Y、Z、W 的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W 原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,Z是使用最广泛的短周期金属元素,下列说法不正确的是( )
A. Y、Z形成的一种化合物强度高、热膨胀系数小,是良好的耐热冲击材料
B. Z的氧化物熔点很高,故工业上常用电解熔融ZW3的方法制取单质Z
C. 离子化合物YX5若存在,YX5与水反应生成气体X2,同时得到一种弱碱溶液
D. 化合物YW3遇水能强烈水解,产物之一具有强氧化性
高二化学单选题中等难度题查看答案及解析
-
已知A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次递增。其中A是形成化合物种类最多的元素;B原子核外有三个未成对电子;C是元素周期表中电负性最大的元素,化合物D2F为离子晶体,F原子核外的M层中只有两对成对电子;E单质的晶体类型在同周期的单质中没有相同的;G原子最外层电子数与D的相同,其余各层均充满电子。请根据以上信息,回答下列问题(答题时,A、B、C、D、E、F、G用所对应的元素符号表示):
(1)C元素在元素周期表中的位置为____________________。
(2)D的氯化物的熔点比E的氯化物的熔点_____(填“高”或“低”),理由是_______。
(3)F的低价氧化物分子的立体构型是________,AO2的电子式为___________。
(4)A、B、D、E四种元素第一电离能最大的是_____。
(5)G2+能形成配离子[G(BH3)4]2+.写出该配离子的结构简式(标明配位键)_____。
(6)A能与氢、氧二种元素构成化合物AH2O,其中A原子的杂化方式为_____,1mol该分子中σ键的数目为_____,该物质能溶于水的主要原因是___________________。
(7)G晶体的堆积方式为__________________堆积,配位数为_________。
高二化学综合题困难题查看答案及解析
-
短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,常见金属元素Z的一种核素的质量数为28,中子数比质子数多2。下列说法中正确的是( )
A. 用“百度”搜索知,Y、Z形成的化合物“室温下强度高,……。导热性好,热膨胀系数小,是良好的耐热冲击材料。”由此可推测该化合物属于离子晶体
B. 化合物YW3水解产物之一具有强氧化性,由此可知Y在该化合物中的化合价为+3
C. 由非金属元素组成的化合物YX5是一种是否存在尚待确证的化合物,假如存在,该物质与水反应必然生成气体X2,同时得到一种弱碱溶液
D. 因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取
高二化学单选题中等难度题查看答案及解析
-
已知:A、B、C、D、E、F五种元素核电荷数依次增大,属周期表中前四周期的元素。其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的熔点在同周期元素形成的单质中是最高的;F原子核外最外层电子数与B相同,其余各层均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为 ___________________________ (用元素符号表示)。
(2)B的氯化物的熔点比D的氯化物的熔点________(填高或低),理由是____________。
(3)E与D的同族短周期元素可形成一种化合物X,X是常见的有机溶剂,X分子的空间构型是________。
(4)A、F形成某种化合物的晶胞结构如图所示,则其化学式为________;(黑色球表示F原子)。
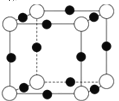
高二化学综合题中等难度题查看答案及解析
-
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC
为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E是原子核外电子排布未成对电子数最多的元素,ECl
能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:
(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为________。
(2)A的氢化物中一种组成为A2H2分子,此分子A中原子轨道的杂化类型为 ,1 mol A2H2含σ键的数目为 。
(3)写出化合物AC2的电子式________;一种由B、C组成的化合物与AC2互为等电子体,其化学式为________。
(4)B、C的氢化物的沸点比A的氢化物的沸点高,其主要原因是 ________
(5)E的价电子排布式是________,ECl3形成的配合物的化学式为________
(6)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是________。
高二化学推断题中等难度题查看答案及解析
-
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构。AC
为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E是原子核外电子排布未成对电子数最多的元素,ECl
能与B、C的氢化物形成六配位的配合物,且B、C的氢化物物质
的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的电负性由小到大的顺序为 。
(2)A的氢化物中一种组成为A2H2分子,此分子A中原子轨道的杂化类型为 ,1 mol A2H2含σ键的数目为 。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为
。
(4)E的价电子排布式是 ,ECl3与B、C的氢化物形成的配合物的化学式为
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的
化学方程式是 。
高二化学填空题困难题查看答案及解析