-
研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用。
(1)已知:①CH4(g)+H2O(g)  CO(g)+3H2(g) △H1=+206.1kJ·mol-1
CO(g)+3H2(g) △H1=+206.1kJ·mol-1
②2H2(g)+CO(g)  CH3OH(l) △H2=-128.3kJ·mol-1
CH3OH(l) △H2=-128.3kJ·mol-1
③2H2(g)+O2(g)  2H2O(g) △H3=-483.6kJ·mol-1
2H2O(g) △H3=-483.6kJ·mol-1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为_________。
(2)利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
| 实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/mol·L-1 | H2O初始浓度/mol·L-1 |
| 1 | 400 | P | 3.0 | 7.0 |
| 2 | T | 101 | 3.0 | 7.0 |
| 3 | 400 | 101 | 3.0 | 7.0 |
①实验2和实验3相比,其平衡常数关系是K2______K3(填“>”、“<”或“=”)。
②将等物质的量的CH4和水蒸气充入1L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10mol,则CH4的转化率为________。
(3)科学家提出由CO2制取C的太阳能工艺如图1所示。
①“重整系统”发生的反应中n(FeO):n(CO2)=6:1,则FexOy的化学式为______________。
②“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________。

(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。若某溶液中溶质的浓度为1×10-3mol·L-1,则该溶液中溶质的pC=-lg(1×10-3)=3。如图2为25℃时H2CO3溶液的pC-pH图。请回答下列问题(若离子浓度小于10-5mol/L,可认为该离子不存在):
①在同一溶液中,H2CO3、HCO3-、CO32-_____________(填“能”或“不能”)大量共存。
②求H2CO3一级电离平衡常数的数值Ka1=________________。
③人体血液里主要通过碳酸氢盐缓冲体系c(H2CO3)/c(HCO3-)可以抵消少量酸或碱,维持pH=7.4。当过量的酸进入血液中时,血液缓冲体系中的c(H+)/c(H2CO3)最终将_______。
A.变大 B.变小 C.基本不变 D.无法判断
-
研究碳及其化合物的相互转化对能源的充分利用、低碳经济有着重要的作用。
(1)已知:①CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206.1 kJ·mol−1
CO(g)+3H2(g) △H1=+206.1 kJ·mol−1
②2H2(g)+ CO(g) CH3OH(l) △H2=−128.3 kJ·mol−1
CH3OH(l) △H2=−128.3 kJ·mol−1
③2H2(g)+ O2(g) 2H2O(g) △H3=−483.6 kJ·mol−1
2H2O(g) △H3=−483.6 kJ·mol−1
25℃时,在合适的催化剂作用下,采用甲烷和氧气一步合成液态甲醇的热化学方程式为__________________________。
(2)利用反应①来制备氢气,为了探究温度、压强对反应①速率、转化率的影响,某同学设计了以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
| 实验序号 | 温度℃ | 压强/kPa | CH4初始浓度/mol·L−1 | H2O初始浓度/mol·L−1 |
| 1 | 400 | p | 3.0 | 7.0 |
| 2 | t | 101 | 3.0 | 7.0 |
| 3 | 400 | 101 | 3.0 | 7.0 |
①实验2和实验3相比,其平衡常数关系是K2__________K3(填“>”“<”或“=”)。
②将等物质的量的CH4和水蒸气充入1 L恒容密闭容器中,发生上述反应,在400℃下达到平衡,平衡常数K=27,此时容器中CO物质的量为0.10 mol,则CH4的转化率为__________。
(3)科学家提出由CO2制取C的太阳能工艺如图1所示。
①“重整系统”发生的反应中n(FeO)∶n(CO2)=6∶1,则FexOy的化学式为______________。
②“热分解系统”中每分解l mol FexOy,转移电子的物质的量为________。
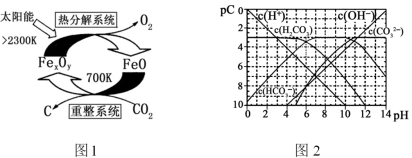
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。若某溶液中溶质的浓度为1×10−3 mol·L−1,则该溶液中溶质的pC=−lg(1×10−3)=3。如图2为25℃时H2CO3溶液的pC−pH图。请回答下列问题 (若离子浓度小于10−5 mol·L−1,可认为该离子不存在):
①在同一溶液中,H2CO3、 、
、 _____________(填“能”或“不能”)大量共存。
_____________(填“能”或“不能”)大量共存。
②求H2CO3一级电离平衡常数的数值Ka1=________________。
③人体血液里主要通过碳酸氢盐缓冲体系 可以抵消少量酸或碱,维持pH=7.4。当过量的酸进入血液中时,血液缓冲体系中的
可以抵消少量酸或碱,维持pH=7.4。当过量的酸进入血液中时,血液缓冲体系中的 最终将_______。
最终将_______。
A.变大 B.变小 C.基本不变 D.无法判断
-
CH4、CO2和碳酸都是碳的重要化合物,实现碳及其化合物的相互转化,对开发新能源和降低碳排放意义重大。
(1)已知:①CH4(g)+H2O(g) CO(g)+3H2(g) △H1=+206.1kJ•mol—1
CO(g)+3H2(g) △H1=+206.1kJ•mol—1
②2H2(g)+CO(g) CH3OH(l) △H2=-128.3kJ•mol—1
CH3OH(l) △H2=-128.3kJ•mol—1
③2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJ•mol—1
写出由甲烷和氧气合成液态甲醇的热化学方程式:_____________________。
(2)若利用反应①来制备氢气。为了探究温度、压强对反应①的影响,设计以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ mol·L—1 | H2O初始浓度/ mol·L—1 |
| 1 | 400 | 101 | 3.0 | 7.0 |
| 2 | T | 101 | 3.0 | 7.0 |
| 3 | 400 | P | 3.0 | 7.0 |
Ⅰ、实验1、实验2和实验3比较,反应开始时正反应速率最快的是_________;平衡时CH4的转化率最小的是_________。
Ⅱ、实验2和实验3相比,其平衡常数关系:K2______K3(填“>”、“<”或“=”)。
(3)科学家提出由CO2制取碳(C)的太阳能工艺如图1所示.
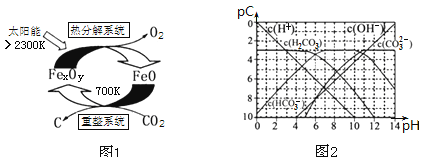
①“重整系统”发生的反应中n(FeO)∶n(CO2)=6∶1,则FexOy的化学式为______;
②“热分解系统”中每分解l mol FexOy,同时生成标准状况下气体体积为_______。
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。如某溶液中溶质的浓度为1×10—2mol•L—1,则该溶液中溶质的pC=﹣lg(1×10—2)=2。上图2为25℃时H2CO3溶液的pC﹣pH图。请回答下列问题:
①在0<pH<4时,H2CO3溶液中主要存在的离子是___________;
②在8<pH<10时,溶液中HCO3—的pC值不随着pH增大而减小的原因是____;
③求H2CO3一级电离平衡常数的数值Ka1= _______________。
-
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
(1)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(I、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图l所示:
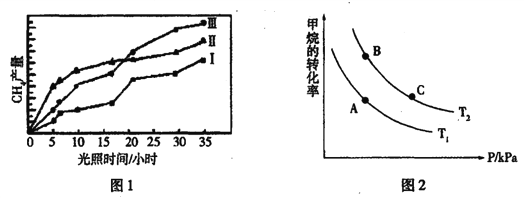
①在0~30小时内,CH4的平均生成速率vI、vⅡ和vⅢ从小到大的顺序为________;反应开始后的12小时内,在第____种催化剂的作用下,收集的CH4最多。
②将所得的CH4与H2O(g)通入聚焦太阳能反应器,发生CH4(g)+H2O(g) CO(g)+3H2(g)反应,在一定条件下,CH4的平衡转化率与温度、压强的关系如图2所示,T2>T1,则上述反应的△H _______0(填“<”、“>”、“=”,下同),A、C处对应平衡常数(KA、KC)的大小关系为KA____KC。
CO(g)+3H2(g)反应,在一定条件下,CH4的平衡转化率与温度、压强的关系如图2所示,T2>T1,则上述反应的△H _______0(填“<”、“>”、“=”,下同),A、C处对应平衡常数(KA、KC)的大小关系为KA____KC。
③维持温度T2,将0.04mol CH4(g)和0.04mol H2O(g)通入容积为1L的定容密闭容器中发生反应,平衡时达到B点,测得CH4的转化率为50%,该反应在此温度下的平衡常数KB=________。
④下列现象能说明该反应已经达到平衡状态的是________(填编号)。
A.容器内CH4、H2O、CO、H2单位物质的量之比为1:1:1:3
B.容器内气体的密度恒定
C.容器内气体的压强恒定
D.3v( CO)=v(H2)
(2)LiBH4为近年来常用的储氢材料。
①反应2LiBH4 =2LiH+2B +3H2↑,生成22.4 L H2(标准状况)时,转移电子的物质的量为____ mol。
②图3是2LiBH4/MgH2体系放氢焓变示意图,则:Mg(s) +2B(s) =MgB2(s) △H=____。
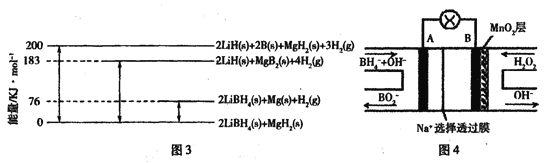
(3)图4是直接硼氢化钠一过氧化氢燃料电池示意图。该电池工作时,正极附近溶液的pH___(填“增大”、“减小”或“不变”),负极的电极反应式为____。
-
实现碳及其化合物的相互转化,对开发新能源和降低碳排放意义重大。
(1)已知:CH4(g)+H2O(g) CO(g)+3H2(g) △H=x
CO(g)+3H2(g) △H=x
已知:标准状态下,由最稳定的单质生成1mol化合物的焓变,称为该化合物的标准摩尔生成焓,几种物质的标准摩尔生成焓如下。则x=__kJ·mol-1。(标准摩尔生成焓:CH4(g)-75kJ/mol;H2O(g)-240kJ/mol;CO(g)-110kJ/mol;H2(g)-0kJ/mol)
(2)为了探究温度、压强对反应(1)的影响,在恒温恒容下,向下列三个容器中均充入4molCH4和4molH2O。
| 容器 | 温度/℃ | 体积/L | CH4平衡浓度/mol·L-1 | 平衡时间/min |
| 甲 | 400 | 1 | 1.5 | 5.0 |
| 乙 | 500 | 1 | x | t1 |
| 丙 | 400 | 2 | y | t2 |
①平衡前,容器甲中反应的平均速率 (H2)=__mol/(L·min);在一定条件下,能判断容器丙中的反应一定处于化学平衡状态的是__(填序号);
(H2)=__mol/(L·min);在一定条件下,能判断容器丙中的反应一定处于化学平衡状态的是__(填序号);
A.3v(CH4)正=v(H2)逆 B.CH4和H2O的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
②平衡后,乙容器中CH4的转换率较丙低,其原因是__,其中t1__t2(填“>”、 “<”或“=”)。
(3)pC是指极稀溶液中溶质物质的量浓度的负对数。已知常温下,H2CO3溶液中加入强酸或强碱后达到平衡时溶液中三种成分的pC-pH图,据图
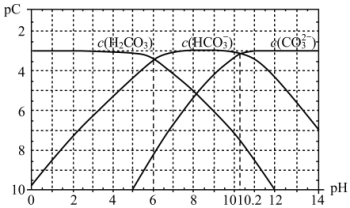
常温下,碳酸的一级电离常数Ka1的数量级为__;其中碳酸的Ka1>>Ka2,其原因是__。
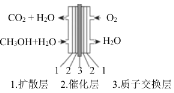
(4)我国科学家根据反应CO2 C+O2↑,结合电解池原理设计出了二氧化碳捕获与转化装置。该装置首先利用电解池中熔融电解质ZrO捕获CO2,发生的相关反应为:①CO2+O2-=CO32-,②2CO2+O2-=C2O52-,然后CO32-在阴极转化为碳单质和__;C2O52-在阳极发生电极反应,其方程式为__。
C+O2↑,结合电解池原理设计出了二氧化碳捕获与转化装置。该装置首先利用电解池中熔融电解质ZrO捕获CO2,发生的相关反应为:①CO2+O2-=CO32-,②2CO2+O2-=C2O52-,然后CO32-在阴极转化为碳单质和__;C2O52-在阳极发生电极反应,其方程式为__。
-
碳及其化合物在科研、工业生产中有着重要作用。请按要求回答下列问题。
(1)一定条件下,CH4 和 CO2 都能与 H2O 形成笼状结构的水合物晶体,CH4 与 H2O形成的水合物俗称“可燃冰”。已知:CO2(g)+nH2O(l)=CO2·nH2O(s)△H=-57.98 kJ·mol-1, CH4(g)+nH2O(l)=CH4·nH2O(s) △H=-54.49 kJ·mol-1 。则反应: CO2(g)+CH4·nH2O(s) = CH4(g) +CO2·nH2O(s)的△H=_______________;该反应能在一定 条件下自发进行的理论依据是______________。
(2)固定和利用 CO2 能有效地利用资源并减少空气中的温室气体。工业上利用 CO2 生产甲醇方法的反应原理:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0。现将6mol CO2 和 8 mol H2 充入一容积为 2 L 的密闭容器中(温度保持不变),测得 H2 的物质的量随时间变化如下图实线所示。
CH3OH(g)+H2O(g) ΔH<0。现将6mol CO2 和 8 mol H2 充入一容积为 2 L 的密闭容器中(温度保持不变),测得 H2 的物质的量随时间变化如下图实线所示。

①该反应在 0~8 min 时,H2 的平均反应速率:_____________;v 正(a)_____________v 正(d)(填“<”“>”“=”);CO2 的平衡转化率:_____________。该温度下平衡常数的值 为_____________。
②若起始反应物投料量不变,重新进行两次实验(每次仅改变某一条件),所测得 H2 的物质的量随时间变化如上图中两条虚线。则 b、c、d 三点平衡常数: K(b)______________K(c)______________K(d)(填“<”“>”“=”)。
③在恒温恒容的条件下,再充入 3 mol CO2 和 4 mol H2,达新平衡时,H2O 的体积分数将______________(填“增大”“不变”或“减小”)
(3)如图为甲醇燃料电池,其负极电极 方程式为______________。
-
天然气是重要的化石能源,其综合利用的研究意义重大。
已知;i.CH4(g)十H2O(g) CO(g)+3H2(g) ∆H=+206kJ•mol-1;
CO(g)+3H2(g) ∆H=+206kJ•mol-1;
ii.CH4(g)+2H2O(g) CO2(g)+4H2(g) ∆H=+165kJ•mol-1;
CO2(g)+4H2(g) ∆H=+165kJ•mol-1;
iii.C(s)十H2O(g) CO(g)十H2(g) ∆H=+131.4kJ•mol-1。
CO(g)十H2(g) ∆H=+131.4kJ•mol-1。
请回答下列问题:
(1)若将物质的量之比为1:1的CH4(g)和H2O(g)充入密闭容器中发生反应i。CH4(g)和CO(g)的平衡体积分数(φ)与温度(T)的关系如图所示:
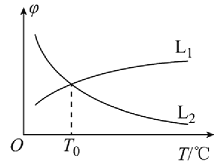
图中表示CH4(g)的平衡体积分数与温度关系的曲线为___(填“L1”或“L2”),原因为__。
(2)合成气的主要组分为CO和H2;以天然气为原料生产的合成气有多种方法,其中Sparg工艺的原理为CH4(g)+CO2(g) 2CO(g)+2H2(g) ∆H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
2CO(g)+2H2(g) ∆H1。T℃下,向容积可变的密闭容器中充入一定量的CH4(g)和CO2(g),改变容器体积,测得平衡时容器内气体的浓度如表所示:
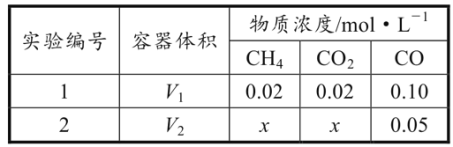
①∆H1=__。
②T℃下,该反应的平衡常数K=__。
③实验1中,CO的平衡体积分数为__%(保留三位有效数字)。
④V1:V2=_。
(3)甲烷在高温下分解生成的炭黑,是生成橡胶的重要原料,其分解原理为CH4(g) C(s)+2H2(g)。
C(s)+2H2(g)。
①一定温度下,将n1molCH4充入1L恒容密闭容器中发生上述反应,tmin末容器内压强变为原来的1.6倍。tmin内该反应的平均反应速率v(H2)=__(用含n1和t的代数式表示)。
②若控制温度和压强不变,充入CH4的物质的量与平衡时H2的体积分数的关系如图所示。充入n1molCH4时,平衡点位于A点,则充入n2molCH4时,平衡点位于__(填“B”“C”或“D”)点。
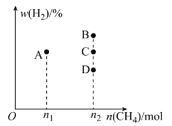
-
“低碳经济”备受关注,二氧化碳的回收利用是环保和能源领域研究的热点课题。
(1)已知:①CO(g)+H2O(g) H2(g)+CO2(g)△H=-41kJ·mol-1
H2(g)+CO2(g)△H=-41kJ·mol-1
②CH4(g) C(s)+2H2(g)△H=+73kJ·mol-1
C(s)+2H2(g)△H=+73kJ·mol-1
③2CO(g) C(s)+CO2(g)△H=-171kJ·mol-1
C(s)+CO2(g)△H=-171kJ·mol-1
写出CO2与H2反应生成CH4和水蒸气的热化学方程式:_________________________。
(2)CO2与H2在催化剂作用下可以合成二甲醚,反应原理如下:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H。某温度下,向体积为2L的密闭容器中充入CO2与H2,发生上述反应。测得平衡混合物中CH3OCH3(g)的体积分数[φ(CH3OCH3) 与起始投料比Z[Z=
CH3OCH3(g)+3H2O(g) △H。某温度下,向体积为2L的密闭容器中充入CO2与H2,发生上述反应。测得平衡混合物中CH3OCH3(g)的体积分数[φ(CH3OCH3) 与起始投料比Z[Z= ]的关系如图1所示;CO2的平衡转化率(a)与温度(T)、压强(p)的关系如图2所示。
]的关系如图1所示;CO2的平衡转化率(a)与温度(T)、压强(p)的关系如图2所示。
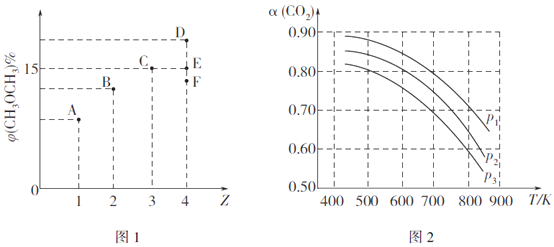
①当Z=3时,CO2的平衡转化率a=__________%。
②当Z=4时,反应达到平衡状态后,CH3OCH3的体积分数可能是图1中的_________点(填"D"、"E"或“F")。
③由图2可知该反应的△H_______0(选填“>”、“<“或“=”,下同),压强p1、p2、p3由大到小的顺序为__________。
④若要进一步提高H2的平衡转化率,除了可以适当改变反应温度和压强外,还可以采取的措施
有________________(任写一种)。
(3)我国科研人员研制出的可充电"Na-CO2"电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示。
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示。
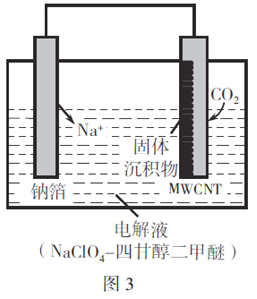
①放电时,正极的电极反应式为____________________。
②若生成的Na2CO3和C全部沉积在正极表面,当正极增加的质量为28g时,转移电子的物质的量为__________。
③可选用高氯酸钠-四甘醇甲醚作电解液的理由是________________________。
-
开发使用清洁能源,发展“低碳经济”正成为科学家研究的主要课题。氢气、甲醇是优质的清洁燃料,可制作燃料电池。
(1)甲烷水蒸气转化法制H2的主要转化反应如下:
CH4(g) + H2O(g) CO(g) + 3H2(g) △H=+206.2 kJ·mol-1
CO(g) + 3H2(g) △H=+206.2 kJ·mol-1
CH4(g) + 2H2O(g) CO2(g) + 4H2(g) △H=+165.0 kJ·mol-1
CO2(g) + 4H2(g) △H=+165.0 kJ·mol-1
上述反应所得原料气中的CO能使合成氨的催化剂中毒,必须除去。工业上常采用催化剂存在下CO与水蒸气反应生成易除去的CO2,同时可制得等体积的氢气的方法。此反应称为一氧化碳变换反应,该反应的热化学方程式是 。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH>0
CO(g) + 3H2(g) ΔH>0
①一定条件下CH4的平衡转化率与温度、压强的关系如图a。则A、B、C三点处对应平衡常数(KA、KB、KC)的大小关系为___________。(填“<”、“>”、“=” );

②100℃时,将1 mol CH4和2 mol H2O通入容积为1 L的定容密封容器中,发生反应,能说明该反应已经达到平衡状态的是__________
a.容器内气体密度恒定
b.单位时间内消耗0.1 mol CH4同时生成0.3 mol H2
c.容器的压强恒定
d.3v正(CH4) = v逆(H2)
(3)25℃时,在20mL0.1mol/L氢氟酸中加入VmL0.1mol/LNaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____。
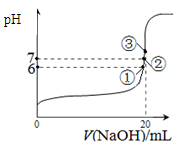
A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(Na+)=0.1mol/L
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与水反应得到HF和化合物A,该反应的化学方程式为 。
-
运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g) CO(g)+3H2(g) ∆H1=+216.4kJ/mol
CO(g)+3H2(g) ∆H1=+216.4kJ/mol
b.CO(g)+H2O(g) CO2(g)+H2(g) ∆H2=–41.2kJ/mol
CO2(g)+H2(g) ∆H2=–41.2kJ/mol
则反应CH4(g)+2H2O(g) CO2(g)+4H2(g)∆H=__。
CO2(g)+4H2(g)∆H=__。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
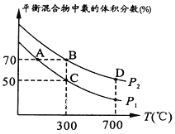
①恒压时,反应一定达到平衡状态的标志是__(填序号)。
A.N2和H2的转化率相等
B.反应体系密度保持不变
C. 保持不变
保持不变
D. =2
=2
②P1__P2(填“>”“<”“=”或“不确定”,下同);反应的平衡常数:B点__D点。
③C点H2的转化率为__;在A、B两点条件下,该反应从开始到平衡时生成氮气的平均速率:v(A)___v(B)。
Ⅱ.用间接电化学法去除烟气中NO的原理如图所示。
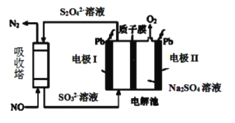
(3)已知阴极室溶液呈酸性,则阴极的电极反应式为__。反应过程中通过质子交换膜(ab)的H+为2mol时,吸收柱中生成的气体在标准状况下的体积为__L。
CO(g)+3H2(g) △H1=+206.1 kJ·mol−1
CH3OH(l) △H2=−128.3 kJ·mol−1
2H2O(g) △H3=−483.6 kJ·mol−1

、
_____________(填“能”或“不能”)大量共存。
可以抵消少量酸或碱,维持pH=7.4。当过量的酸进入血液中时,血液缓冲体系中的
最终将_______。















