-
Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)Ca小于Ti的是_______(填标号)。
A.最外层电子数 B.未成对电子数 C.原子半径 D.第三电离能
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
① Cl2O2的沸点比H2O2低,原因是___________________________________。
② O3分子中心原子杂化类型为_______;O3是极性分子,理由是___________________。
(3)Na3OCl可由以下两种方法制得:
方法Ⅰ Na2O + NaCl Na3OCl
Na3OCl
方法II 2Na + 2NaOH + 2NaCl 2Na3OCl + H2↑
2Na3OCl + H2↑
① Na2O的电子式为____________。
② 在方法Ⅱ的反应中,形成的化学键有_______(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
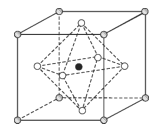
(4)Na3OCl晶体属于立方晶系,其晶胞结构如右所示。已知:晶胞参数为a nm,密度为d g·cm-3。
①Na3OCl晶胞中,Cl位于各顶点位置,Na位于_________位置,两个Na之间的最短距离为________nm。
②用a、d表示阿伏加德罗常数的值NA=__________________(列计算式)。
-
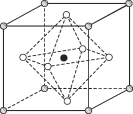
根据下面图示回答问题:

(1)A图是某离子化合物的晶胞,阳离子位于中间,阴离子位于8个顶点,该化合物中阳、阴离子的个数比是________。
(2)B图若Ca、Ti、O形成的某钙钛矿型晶体结构如B图,其化学式为________。
(3)原子晶体硼的基本结构单元都是由硼原子组成的正二十面体,如C图。其中含有20个等边三角形和一定数目的顶角,每个顶角上各有1个原子。试观察该图,推断这个基本结构单元所含硼原子个数、键角、B—B键的个数依次为________、________、_______。
(4)图D所示的物质结构中最外层已达8电子结构的原子是________(填元素符号),H3BO3晶体中B原子个数与极性键个数比为________;
(5)金属铜具有很好的延展性、导电传热性,对此现象最简单的解释是用“________”理论;
-
如图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单位。
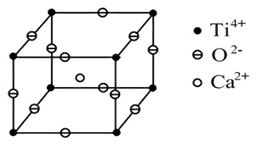
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的氧离子、钙离子各有 、 个。
(2)该晶体结构中,元素氧、钛、钙的离子个数比是 ,该物质的化学式可为 。
(3)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构图中正方体边长(钛原子之间的距离)为d nm(1 nm=10-9 m),阿伏加德罗常数为6.02×1023 mol-1,则该晶体的密度为 g·cm-3。
-
如图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单位。

(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有__、__个。
(2)该晶体结构中,元素氧、钛、钙的离子个数比是__.该物质的化学式可表示为__。
(3)若钙、钛、氧三元素的相对原子质量分别为a,b,c,晶体结构图中正方体边长(钛离子之间的距离)为dnm(1nm=10﹣9m),则该晶体的密度为__g/cm3。
-
如图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单位。
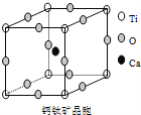
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有__、__个。
(2)该晶体结构中,元素氧、钛、钙的离子个数比是__.该物质的化学式可表示为__。
(3)若钙、钛、氧三元素的相对原子质量分别为a,b,c,晶体结构图中正方体边长(钛离子之间的距离)为dnm(1nm=10﹣9m),则该晶体的密度为__g/cm3。
-
如图所示为高温超导领域里的一种化合物——钙钛矿的晶体结构,该结构是具有代表性的最小结构重复单元。
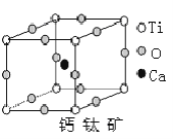
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子、氧离子各有_____________、_____________、_____________个。
(2)该晶体结构中,Ca、Ti、O个数比是___________;该物质的化学式可表示为___________。
-
(12分)如图所示的结构为高温超导领域里的一种化合物—钙钛矿晶体结构,该结构是其晶体中具有代表性的最小重复单位。
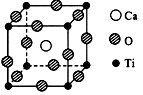
(1)钪的价电子排布图 在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有_____个、 ______个。
(2)该晶体结构中,氧、钛、钙的原子个数比是____,该物质的化学式可表示为____。
(3)若钙、钛、氧三元素的相对原子质量分别为A、b、c,晶体结构图中正方体边长(钛原子之间的距离) 为dnm(1nm=10-9m),则该晶体的密度为________g/cm3。(写出表达式即可)
-
如图为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单位。
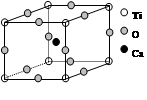
(1)在该物质的晶体结构中,每个钛离子周围与它最接近且距离相等的钛离子、钙离子各有________、________个。
(2)该晶体结构中,元素氧、钛、钙的离子个数比是________。该物质的化学式可表示为________。
(3)若钙、钛、氧三元素的相对原子质量分别为a,b,c,晶体结构图中正方体边长(钛原子之间的距离)为dnm(1nm=10-9m),则该晶体的密度为________g/cm3(阿伏加德罗常数用NA表示)。
-
如右图所示为高温超导领域里的一种化合物——钙钛矿晶体结构,该结构是具有代表性的最小重复单元。
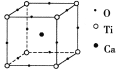
(1)在该物质的晶体结构中,每个钛离子周围与它最近且距离相等的钛离子、钙离子各有__________个、__________个。
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶体结构如图中正方体边长(钛原子之间的距离)为d nm(1 nm=1×10-9 m),则该晶体的密度为__________g/cm3(阿伏加德罗常数用NA表示)。
-
原子晶体是由原子直接通过共价键形成的空间网状结构的晶体,又称共价晶体,因其具有高熔沸点、硬度大、耐磨等优良特性而具有广泛的用途。
(1)晶体硅是良好的半导体材料,被广泛用于信息技术和能源科学等领域。晶体硅是与金刚石结构类似的晶体(其晶胞如图乙所示),硅晶体的1个晶胞中含_____个Si原子,在晶体硅的空间网状结构中最小环为_____元环,每最小环独立含有__________个Si原子,含1molSi原子的晶体硅中Si-Si键的数目为_____。
(2)金刚砂(SiC)也与金刚石具有相似的晶体结构(如图丙所示),在金刚砂的空间网状结构中,碳原子、硅原子交替以共价单键相结合。试回答下列问题:
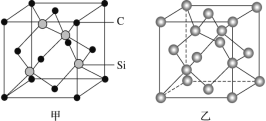
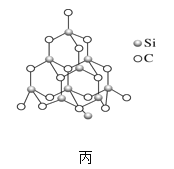
①金刚砂、金刚石、晶体硅的熔点由低到高的顺序是_____(均用化学式表示)。
②在金刚砂的结构中,一个碳原子周围结合了_____硅个原子,其键角是_____。
③金刚砂的结构中含有C、Si原子以共价键结合形成的环,其中一个最小的环上独立含有_个C-Si键
④金刚砂的晶胞结构如图甲所示,在SiC中,每个C原子周围最近等距的C原子数目为_____;若金刚砂的密度为ρg·cm-3,阿伏加德罗常数为NA,则晶体中最近的两个碳硅原子之间的距离为_________pm(用代数式表示即可)。
 2Na3OCl+H2↑,在该反应中,形成的化学键有_____(填标号)。
2Na3OCl+H2↑,在该反应中,形成的化学键有_____(填标号)。