-
中药药剂砒霜(主要成分为As2O3,微溶于水),可用于治疗急性白血病。工业上用含硫化砷(As2S3)的废渣生产砒霜的工艺流程如图所示:
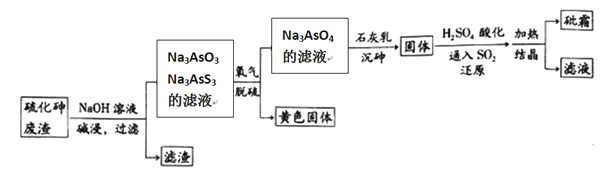
(1)硫化砷中砷元素化合价为__________,其难溶于水,“碱浸”过程中硫元素价态不变,发生的主要反应的离子方程式为________________________。
(2)氧化脱硫过程中被氧化的元素是____________。
(3)还原过程中H3AsO4转化为H3AsO3,反应的化学方程式是____________________。
(4)“沉砷”是在一定温度下将砷元素转化为Ca5(AsO4)3OH沉淀的过程,主要反应有:
a.Ca(OH)2(S) Ca2+(aq) +2OH-(aq) Ksp=10-7
Ca2+(aq) +2OH-(aq) Ksp=10-7
b.Ca5(AsO4)3OH (S) 5Ca2+(aq)+OH-(aq)+3AsO43-(aq) Ksp=10-40
5Ca2+(aq)+OH-(aq)+3AsO43-(aq) Ksp=10-40
加入石灰乳调溶液中c(OH-) =0.01mol • L-1,此时溶液中c(AsO43-) =________________。(已知:  =2. 15)
=2. 15)
(5)还原后加热溶液,H3AsO3分解为As2O3,结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度度(S)曲线如下图所示。
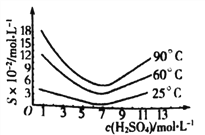
为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为_________________。
(6)在工业生产中,最后一步所得滤液可循环使用,其目的是____________________。
(7)砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
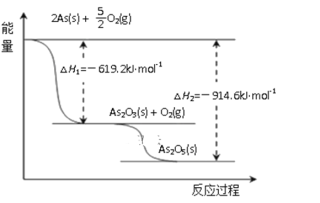
①砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式___________________________________________。
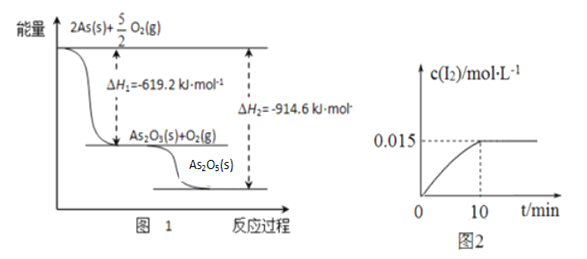
②砷酸钠具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+ AsO33-(无色)+I2(浅黄色)+H2O ,测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
AsO33-(无色)+I2(浅黄色)+H2O ,测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率 d.  保持不再变化
保持不再变化
-
中药药剂砒霜(主要成分为As2O3,微溶于水),可用于治疗急性白血病。工业上用含硫化砷(As2S3)的废渣生产砒霜的工艺流程如图所示:
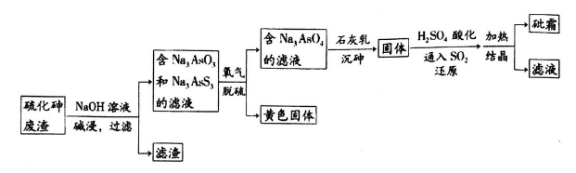
(1)硫化砷中砷元素化合价为__________,其难溶于水,“碱浸”过程中硫元素价态不变,发生的主要反应的离子方程式为________________________。
(2)氧化脱硫过程中被氧化的元素是____________。
(3)还原过程中H3AsO4转化为H3AsO3,反应的化学方程式是____________________。
(4)“沉砷”是在一定温度下将砷元素转化为Ca5(AsO4)3OH沉淀的过程,主要反应有:
a.Ca(OH)2(S) Ca2+(aq) +2OH-(aq) Ksp=10-7
Ca2+(aq) +2OH-(aq) Ksp=10-7
b.Ca5(AsO4)3OH (s) 5Ca2+(aq)+OH-(aq)+3AsO43-(aq) Ksp=10-40
5Ca2+(aq)+OH-(aq)+3AsO43-(aq) Ksp=10-40
加入石灰乳调溶液中c(OH-) =0.01mol • L-1,此时溶液中c(AsO43-) =________________。
(已知:  =2. 15)
=2. 15)
(5)还原后加热溶液,H3AsO3分解为As2O3,结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度度(S)曲线如下图所示。
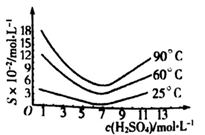
为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为_________________。
(6)在工业生产中,最后一步所得滤液可循环使用,其目的是____________________。
-
中药药剂砒霜(主要成分为As2O3,微溶于水),可用于治疗急性白血病。工业上用含硫化砷(As2S3)的废渣生产砒霜的工艺流程如图所示:
(1)硫化砷中砷元素化合价为__________,其难溶于水,“碱浸”过程中硫元素价态不变,发生的主要反应的离子方程式为________________________。
(2)氧化脱硫过程中被氧化的元素是____________。
(3)还原过程中H3AsO4转化为H3AsO3,反应的化学方程式是____________________。
(4)“沉砷”是在一定温度下将砷元素转化为Ca5(AsO4)3OH沉淀的过程,主要反应有:
a.Ca(OH)2(S) Ca2+(aq) +2OH-(aq) Ksp=10-7
Ca2+(aq) +2OH-(aq) Ksp=10-7
b.Ca5(AsO4)3OH (S) 5Ca2+(aq)+OH-(aq)+3AsO43-(aq) Ksp=10-40
5Ca2+(aq)+OH-(aq)+3AsO43-(aq) Ksp=10-40
加入石灰乳调溶液中c(OH-) =0.01mol • L-1,此时溶液中c(AsO43-) =________________。(已知:  =2. 15)
=2. 15)
(5)还原后加热溶液,H3AsO3分解为As2O3,结晶得到粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度度(S)曲线如下图所示。
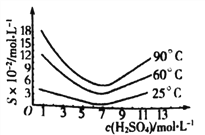
为了提高粗As2O3的沉淀率,“结晶”过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为_________________。
(6)在工业生产中,最后一步所得滤液可循环使用,其目的是____________________。
(7)砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
①砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式___________________________________________。
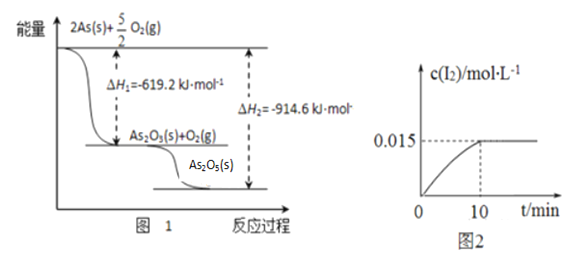
②砷酸钠具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+ AsO33-(无色)+I2(浅黄色)+H2O ,测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
AsO33-(无色)+I2(浅黄色)+H2O ,测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.溶液颜色保持不再变化 b.c(AsO33-)+c(AsO43-)不再变化
c.AsO43-的生成速率等于I2的生成速率 d.  保持不再变化
保持不再变化
-
目前中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病。工业上利用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取As2O3的工艺流程如下:
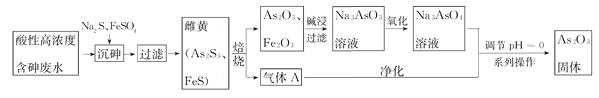
已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) 2AsS32-
2AsS32-
回答下列问题:
(1)H3AsO3是一种两性偏酸性的化合物,As元素的化合价为_____________。
(2)“沉砷”中FeSO4的作用是________________________。
(3)“焙烧”过程产生的气体A的化学式为____________,检验该气体常用试剂为___________。
(4)调节pH=0时,发现酸性越强,As2O3的产率越高。可能的原因是__________________。获得As2O3固体,系列操作是________、______、_______。
(5)残留废渣中少量砒霜(As2O3)可以用双氧水氧化成H3AsO4而除去,该反应的化学方程式为:__________________________________。
-
中药药剂砒霜(主要成分As2O3,微溶于水)在医疗上用于治疗急性白血病。某课题组以一种含砷精矿石粉(主要成份为As4S4、As2S3、FeS2及其它惰性杂质)为原料制取As2O3, 工艺流程简图如下:
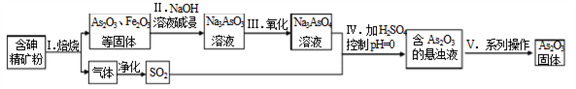
回答下列问题:
(1)过程I中所得SO2气体可回收再利用,下列有关SO2用途的说法正确的是______。
A.工业制硫酸 B.漂白纸张 C.自来水消毒
(2)过程II中发生的反应______氧化还原反应(填“是”或“不是”)。
(3)过程V中系列操作为_______ (填化学实验基本操作名称)。
(4)①过程I中焙烧As2S3的化学反应方程式为_______________。
②过程IV中生成As2O3的离子反应方程式为_______________。
(5)有毒的AsO33-通过电解反应可转化为无毒的AsO43-。用石墨为电极,在强碱性溶液中
电解含AsO33-的溶液,阳极的电极反应式为______________。
(6)测定某As2O3粗产品(含As2O5杂质)中As2O3的质量分数的实验过程如下:
a.称取m g粗产品溶解于NaOH溶液,得到含AsO33-、AsO43-的混合溶液l00mL。
b.分别移取25.00mL上述溶液,用0.02500 mol·L-1的I2标准溶液进行滴定(I2将AsO33-氧化为AsO43-,淀粉溶液为指示剂)。每次滴定开始时液面读数如图一所示,三次滴定结束时,I2标准溶液液面读数如图二〜图四所示。
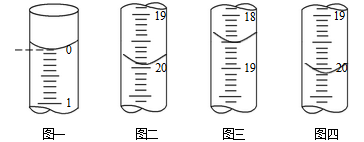
①描述滴定终点的现象_____________________。
②粗产品中As2O3的质量分数为______________ (用含有m的代数式表示)。
-
中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As是33号元素,则其在周期表中的位置是________________。
(2)N元素非金属性比As强,下列说法正确的是_________________________。
①NH3的热稳定性比AsH3差 ②HNO3的酸性比H3AsO4强 ③N的原子半径比As的原子半径小
(3)根据下图写出As2O5分解为As2O3的热化学方程式__________________。
(4)查文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如下:

①As2S3、Na3AsS3中的S均为-2价,碱浸过程中发生的反应______(填“是”或“不是”)氧化还原反应。
②过程Ⅲ的系列操作包括________________________________________________。
③写出过程Ⅲ的离子方程式__________________________________________________,过程Ⅲ中,酸性越强,As2O3的产率越高,请解释其原因______________________________。
-
中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As的原子结构示意图为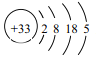 ,则其在周期表中的位置是______________________。
,则其在周期表中的位置是______________________。
(2)N元素非金属性比As强,下列说法正确的是___________________________。
①NH3的热稳定性比AsH3差 ②HNO3的酸性比H3AsO4强 ③N的原子半径比As的原子半径小
(3)根据下图写出As2O5分解为As2O3的热化学方程式______________________________________。

(4)查文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如下:

①As2S3、Na3AsS3中的S均为-2价,碱浸过程中发生的反应________(填“是”或“不是”)氧化还原反应。
②过程Ⅲ的系列操作包括________________________________________。
③写出过程Ⅲ的离子方程式_________________________________,过程Ⅲ中,酸性越强,As2O3的产率越高,请解释其原因________________________________。
-
中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As的原子结构示意图为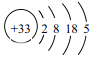 ,则其在周期表中的位置是______________________。
,则其在周期表中的位置是______________________。
(2)N元素非金属性比As强,下列说法正确的是___________________________。
①NH3的热稳定性比AsH3差 ②HNO3的酸性比H3AsO4强 ③N的原子半径比As的原子半径小
(3)根据下图写出As2O5分解为As2O3的热化学方程式______________________________________。
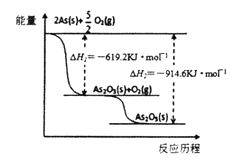
(4)查文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如下:

①As2S3、Na3AsS3中的S均为-2价,碱浸过程中发生的反应________(填“是”或“不是”)氧化还原反应。
②过程Ⅲ的系列操作包括________________________________________。
③写出过程Ⅲ的离子方程式_________________________________,过程Ⅲ中,酸性越强,As2O3的产率越高,请解释其原因________________________________。
-
中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分As2O3)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。
(1)As的原子结构示意图为 ,则其在周期表中的位置是_____________。
,则其在周期表中的位置是_____________。
(2)N元素非金属性比As强,下列说法正确的是_______。
①NH3的热稳定性比AsH3差
②HNO3的酸性比H3AsO4强
③N的原子半径比As的原子半径小
(3)根据下图写出As2O5分解为As2O3的热化学方程式____________________。

(4)查文献得知,可以从硫化砷(As2S3)废渣中提取As2O3,提取的工艺流程简图如下:
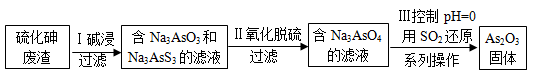
①As2S3、Na3AsS3中的S均为-2价,碱浸过程中发生的反应________(填“是”或“不是”)氧化还原反应。
②过程Ⅲ的系列操作包括_________________________。
③写出过程Ⅲ的离子方程式_________________,过程Ⅲ中,酸性越强,As2O3的产率越高,请解释其原因____________________。
-
三氧化二砷(As2O3)可用于治疗急性早幼粒白血病。利用某酸性含砷废水(含 、H+、
、H+、 )可提取三氧化二砷,提取工艺流程如下:
)可提取三氧化二砷,提取工艺流程如下:
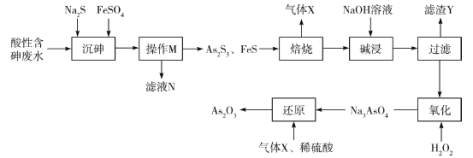
已知:①常温下, ;
; 。
。
②As2O3+6NaOH=2Na3AsO3+3H2O。
③As2S3易溶于过量的Na2S溶液中,故加入FeSO4的目的是除去过量的S2-。
回答下列问题:
(1)操作M的名称是________,滤液N中含有的阳离子有Fe2+、H+、________。
(2)“焙烧”操作中,As2S3参与反应的化学方程式为____________。
(3)“碱浸”的目的是_____________,“滤渣Y”的主要成分是_____________(写化学式)。
(4)“氧化”中发生反应的离子方程式为___________________。
(5)该流程中可循环使用的物质是_________(写化学式),某次“还原”过程中制得了1.98kgAs2O3,则消耗标准状况下该物质的体积是________L。
(6)溶液中金属离子的除去方法之一是Na2S沉降法。常温下,若某溶液中含Fe2+、Ag+,且浓度均为0.1mol·L-1,则向该溶液中滴加稀Na2S溶液时,先生成的沉淀是________(填化学式)。

Ca2+(aq) +2OH-(aq) Ksp=10-7
5Ca2+(aq)+OH-(aq)+3AsO43-(aq) Ksp=10-40
=2. 15)


AsO33-(无色)+I2(浅黄色)+H2O ,测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
保持不再变化










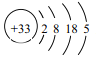 ,则其在周期表中的位置是______________________。
,则其在周期表中的位置是______________________。

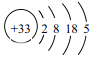 ,则其在周期表中的位置是______________________。
,则其在周期表中的位置是______________________。



