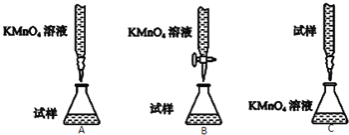-
某化学兴趣小组为了测定某草酸晶体的纯度设计了如下实验。化学反应如下:KMnO4+H2C2O4+H2SO4—K2SO4+MnSO4+CO2↑+H2O(未配平)实验主要步骤如下:
Ⅰ、称取2.8g草酸晶体(H2C2O4·2H2O)配成100mL草酸溶液
Ⅱ、取25.00ml草酸溶液于锥形瓶中,加入适量稀硫酸,用0.1000mol·L-1酸性高锰酸钾溶液滴定,消耗KMnO4溶液20.00mL。

根据上述实验步骤请回答下列问题:
(1)高锰酸钾溶液应盛装于__________ (填“甲”或“乙”)滴定管。
(2)滴定到达终点的判断标志是_________________________________。
(3)下列造成草酸晶体质量分数偏高的是__________。
A.滴定终点读数时俯视 B.滴定前有气泡,滴定后气泡消失
C.润洗锥形瓶 D.流定过程中加入少量蒸馏水冲洗瓶壁
(4)完成酸性高锰酸钾溶液和H2C2O4(已知草酸为弱酸)溶液反应的离子方程式:__________________。
(5)该草酸晶体的质量分数为_____________________________。
-
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
(1)称取13.0 g草酸晶体,配成250.00 mL水溶液.此操作过程必须用到的2种定量仪器是 ______ 和 ______ .
(2)量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.
①量取25.00 mL草酸溶液
②酸化KMnO4溶液的酸应为 ______ .(选填“盐酸”或“稀硫酸”或“稀硝酸”)
③配平离子方程式:_______________________ □MnO4-+□H2C2O4+□H+→□Mn2++□CO2↑+□H2O
④滴定达到终点的标志是 ______ .

(3)在上述实验中,下列操作一定会造成测定结果偏低的是 ______ .
A.称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后未用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
-
某化学实验小组用0.2000 mol/L的酸性KMnO4溶液测定草酸晶体的纯度(草酸晶体化学式为H2C2O4•2H2O,杂质不与KMnO4反应).实验步骤如下:
(1)称取13.0 g草酸晶体,配成250.00 mL水溶液.此操作过程必须用到的2种定量仪器是 ______ 和 ______ .
(2)量取草酸溶液25.00 mL放入锥形瓶中,用0.2000 mol/L的酸性KMnO4溶液滴定.
①量取25.00 mL草酸溶液
②酸化KMnO4溶液的酸应为 ______ .(选填“盐酸”或“稀硫酸”或“稀硝酸”)
③配平离子方程式:_______________________ □MnO4-+□H2C2O4+□H+→□Mn2++□CO2↑+□H2O
④滴定达到终点的标志是 ______ .

(3)在上述实验中,下列操作一定会造成测定结果偏低的是 ______ .
A.称取13.0 g草酸晶体时,将草酸晶体放在托盘天平右盘
B.锥形瓶水洗后未用草酸溶液润洗
C.读取KMnO4溶液体积时,开始仰视读数,滴定结束时俯视读数
D.盛KMnO4溶液的酸式滴定管尖嘴部分有气泡,滴定后气泡消失.
-
为了测定草酸晶体(H2C2O4·xH2O)中的x值,进行如下实验:
①称取Wg草酸晶体,配成100.00mL溶液。
②取25.00mL所配溶液于锥形瓶内,加入适量稀H2SO4,用amol/L KMnO4溶液滴定。
试回答:
(1)写出滴定过程中反应的化学方程式: 。
(2)实验中,标准液KMnO4应装在 (填“酸式”或“碱式”)滴定管中。滴定终点时溶液由 色变为 色,且在30s内颜色不再恢复为原来颜色。
(3)若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴至终点,则所测得的x值会 (填“偏大”、“偏小”或“无影响”)。
(4)在滴定过程中若用去amol/L KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为 mol/L,由此x= 。
-
(13分)某校某班化学兴趣小组进行了下列两项试验活动:(1)探究草酸(H2C2O4)与高锰酸钾溶液在不同条件下反应的快慢;(2)测定草酸晶体的纯度。已知:① 在酸性环境下的还原产物是
在酸性环境下的还原产物是 ;②草酸是二元弱酸。
;②草酸是二元弱酸。
Ⅰ.探究草酸与高锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入 的草酸溶液
的草酸溶液 ,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸溶液 |  固体 固体
| 
 溶液 溶液
| 褪色时间 |
| 1 | 65℃ | — | — | 1.0mL | 100s |
| 2 | 65℃ | 10滴 | — | 1.0mL | 90s |
| 3 | 75℃ | 10滴 | — | 1.0mL | 40s |
| 4 | 75℃ | 10滴 | 加入少许 | 1.0mL | 3s |
根据以上4组实验,可以得出的结论主要有_______________________________。
Ⅱ.测定草酸晶体的纯度
用托盘天平称取草酸晶体 样品
样品 ;配制成
;配制成 溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶外还需要的一种玻璃仪器是____________。(填仪器名称)
(2)上述 溶液与酸性
溶液与酸性 溶液反应的离子方程式为_________。
溶液反应的离子方程式为_________。
(3)若滴定过程中平均消耗酸性高锰酸钾溶液VmL,则草酸晶体的纯度为_______(以含W、V的表达式表示)。
-
(15分)某校某班化学兴趣小组进行了下列两项试验活动:(1)探究草酸(H2C2O4)与高锰酸钾溶液在不同条件下反应的快慢;(2)测定草酸晶体的纯度。已知:① 在酸性环境下的还原产物是
在酸性环境下的还原产物是 ;②草酸是二元弱酸。
;②草酸是二元弱酸。
Ⅰ.探究草酸与高锰酸钾溶液在不同条件下反应的快慢
取4支试管,分别加入 的草酸溶液
的草酸溶液 ,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
,按下表中四种方案分别加入相应的试剂,使其发生反应。四支试管中均可观察到有气泡产生,且溶液的颜色变化都为:紫红色→红色→橙红色→橙色→黄色→无色,溶液褪为无色所需的时间如下表所示(表中“—”表示未加入该试剂)。
| 实验 编号 | 反应温度 (利用水浴加热) | 稀硫酸溶液 |  固体 固体
| 
 溶液 溶液
| 褪色时间 |
| 1 | 65℃ | — | — | 1.0mL | 100s |
| 2 | 65℃ | 10滴 | — | 1.0mL | 90s |
| 3 | 75℃ | 10滴 | — | 1.0mL | 40s |
| 4 | 75℃ | 10滴 | 加入少许 | 1.0mL | 3s |
根据以上4组实验,可以得出的结论主要有_______________________________。
Ⅱ.测定草酸晶体的纯度
用托盘天平称取草酸晶体 样品
样品 ;配制成
;配制成 溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
溶液;每次移取25.00mL该溶液于锥形瓶中,用0.10mol/L酸性高锰酸钾溶液滴定;滴定实验重复操作2—3次。请回答:
(1)实验中需要用到的玻璃仪器除了玻璃棒、烧杯、锥形瓶、胶头滴管、250mL容量瓶外还需要的一种玻璃仪器是____________。(填仪器名称)
(2)上述 溶液与酸性
溶液与酸性 溶液反应的离子方程式为_________。
溶液反应的离子方程式为_________。
(3)若滴定过程中平均消耗酸性高锰酸钾溶液VmL,则草酸晶体的纯度为_______(以含W、V的表达式表示)。
-
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
| ② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
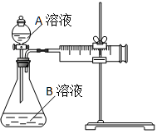
(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
 (5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:

① ;② 。
-
用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
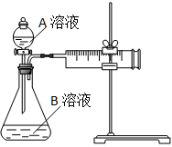
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
| ② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
(1)该反应的离子方程式 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是 < (填实验序号)。
(3)若实验①在2 min末收集了2.24 mL CO2(标准状况下),则在2 min末, c(MnO4-)=__________mol/L(假设混合液体积为50 mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。(一条即可)
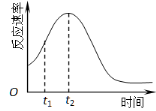 (5)小组同学发现反应速率总是如右图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如右图,其中t1~t2时间内速率变快的主要原因可能是:
① ;② 。
-
草酸晶体(H2C2O4·2H2O)加热到170 ℃以上分解,草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。某校化学兴趣小组欲探究草酸晶体受热分解的产物,设计了如下实验装置。
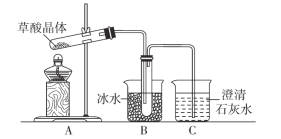
回答下列问题:
(1)C中的现象是___________。
(2)B装置的作用______________。
(3)下列说法不正确的是______________。
A.装置连接完成后,需先检查装置的气密性,然后加入药品
B.反应生成的CO2能完全被C中石灰水吸收
C.由实验可知,草酸分解只生成H2O和CO2
D.盛装草酸晶体的大试管应开口略向下倾斜
-
为测定该补血剂样品[主要成分是硫酸亚铁晶体(FeSO4·7H2O)]中铁元素的含量,某化学兴趣小组设计了两套实验方案:
方案一:用酸性KMnO4溶液滴定测定铁元素的含量
(1)写出滴定反应的离子方程式 .
(2)下列滴定方式中,最合理的是 (夹持部分略去)(填字母序号).
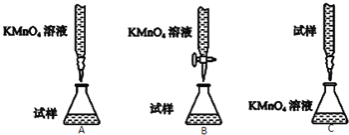
(3)实验前,首先要准确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需 (填仪器名称).
方案二 将FeSO4转化为Fe2O3,测定质量变化操作流程如下:

(4)步骤②中除用H2O2外还可以使用的物质是 .
(5)步骤②是否可以省略 ,理由是 .
(6)步骤④中一系列操作依次是:过滤、洗涤、 、冷却、称量.
(7)假设实验无损耗,则每片补血剂含铁元素的质量 g(用含a的代数式表示).


 (5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:

 (5)小组同学发现反应速率总是如右图,其中t1~t2时间内速率变快的主要原因可能是:
(5)小组同学发现反应速率总是如右图,其中t1~t2时间内速率变快的主要原因可能是: