-
低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g) + H2O(g) H2(g) + CO2(g)的平衡常数随温度的变化如下表:
H2(g) + CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述正反应方向是________反应(填“放热”或“吸热”)。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图,则0~4 min的平均反应速率v(CO)=______ mol/(L·min)。
t1℃时物质浓度(mol/L)的变化
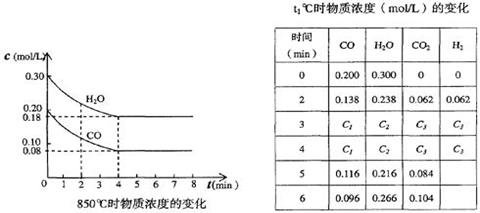
| 时 间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
(3) t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min~4 min之间反应处于_____状态;C1数值_____0.08 mol/L (填大于、小于或等于)。
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是____(单选),表中5 min~6 min之间数值发生变化,可能的原因是______(单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为:________。
(5)若在850℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为X;平衡时CO转化率为Y,试推导Y随X变化的函数关系式为。
(6) 工业上利用N2和H2可以合成NH3,NH3又可以进一步制备联氨(N2H4)等。已知:
N2(g) + 2O2(g) =2NO2(g) △H = +67.7 kJ·mol-1
N2H4(g) + O2(g) =N2(g) + 2H2O(g) △H = -534.0 kJ·mol-1
NO2(g)  1/2N2O4(g) △H = -26.35 kJ·mol-1
1/2N2O4(g) △H = -26.35 kJ·mol-1
试写出气态联氨在气态四氧化二氮中燃烧生成氮气和气态水的热化学方程式:
________________________________________________________。
-
低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题.
已知:CO(g)+H2O(g)⇌H2(g)+CO2(g)△H=a kJ•mol-1 的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
(1)上述正反应方向是______反应(填“放热”或“吸热”).
t1℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0.200 | 0.300 | | |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3[m] |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
(2)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表.
①与2min时相比,3min时密闭容器中混合气体的平均摩尔质量______(填增大、减小或不变).
②表中3min~4min之间反应处于______状态;CO的体积分数______16% (填大于、小于或等于).
③反应在4min~5min,平衡向逆方向移动,可能的原因是______(单选),表中5min~6min之间数值发生变化,可能的原因是______(单选).
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
(3)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为______.

-
( 10分)低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。已知:CO(g) + H2O(g) H2(g) + CO2(g) △H= a kJ·mol-1 的平衡常数随温度的变化如下表:
H2(g) + CO2(g) △H= a kJ·mol-1 的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
(1)上述正反应方向是________反应(填“放热”或“吸热”)。
t1℃时物质浓度(mol/L)的变化

| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
(2) t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。①与2min时相比,3min时密闭容器中混合气体的平均摩尔质量________(填增大、减小或不变)。
②表中3 min~4 min之间反应处于________状态;CO的体积分数________16% (填大于、小于或等于)。
③反应在4 min~5 min,平衡向逆方向移动,可能的原因是____(单选),表中5 min~6 min之间数值发生变化,可能的原因是______(单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
(3)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为________。
-
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题。已知:
CO(g)+H2O(g) H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
试回答下列问题
(1)上述正向反应是 ________反应 (填“放热”或“吸热”)
(2)要使上述反应的逆反应速率增大且平衡正反应方向移动,下列措施不可行的有________
A、加入催化剂 B、增大CO的物质的量以提高体系的压强
C、降低温度 D、减小H2的浓度
(3)向某密闭容器中充入2molCO和4molH2O(g),发生反应:CO(g)+H2O(g) H2(g)+CO2(g),当反应达平衡时,CO的体积分数为X,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数不等于X的有________
H2(g)+CO2(g),当反应达平衡时,CO的体积分数为X,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数不等于X的有________
A、1molCO(g)+4molH2O+2molCO2(g)+2molH2(g) B、2molCO(g)+2molH2O+2molCO2(g)+2molH2(g)
C、1molCO(g)+3molH2O+0.8molCO2(g)+0.8molH2(g) D、1molCO(g)+3molH2O+1molCO2(g)+1molH2(g)
(4)若反应在800℃时进行,设起始CO和H2O(g)共为5mol,水蒸气的体积分数为X;平衡时CO的转化率为y,则y随x变化的函数关系式为y=________
(5)在VL密闭容器中通入10mol CO和10mol水蒸气,在T℃达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2845KJ(已知CO燃烧热为283KJ/mol,H2燃烧热为286KJ/mol),则T℃平衡常数K=________ ,T=________ K(0℃时T=273K)
-
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.已知:CO(g)+H2O(g)⇌H2(g)+CO2(g)平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
试回答下列问题
(1)上述正向反应是________反应 (填“放热”或“吸热”)
(2)要使上述反应的逆反应速率增大且平衡正反应方向移动,下列措施不可行的有________
A、加入催化剂 B、增大CO的物质的量以提高体系的压强
C、降低温度 D、减小H2的浓度
(3)向某密闭容器中充入2molCO和4molH2O(g),发生反应:CO(g)+H2O(g)⇌H2(g)+CO2(g),当反应达平衡时,CO的体积分数为X,若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数不等于X的有________
A、1molCO(g)+4molH2O+2molCO2(g)+2molH2(g) B、2molCO(g)+2molH2O+2molCO2(g)+2molH2(g)
C、1molCO(g)+3molH2O+0.8molCO2(g)+0.8molH2(g) D、1molCO(g)+3molH2O+1molCO2(g)+1molH2(g)
(4)若反应在800℃时进行,设起始CO和H2O(g)共为5mol,水蒸气的体积分数为X;平衡时CO的转化率为y,则y随x变化的函数关系式为y=________
(5)在VL密闭容器中通入10mol CO和10mol水蒸气,在T℃达到平衡,然后急速通过碱石灰,将所得混合气体燃烧,测得放出的热量为2845KJ(已知CO燃烧热为283KJ/mol,H2燃烧热为286KJ/mol),则T℃平衡常数K=________,T=________ K
(0℃时T=273K)
-
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如表:
H2(g)+CO2(g)的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数Kc | 9.94 | 9 | 1 |
试回答下列问题:
(1)上述正向反应是:________ 反应(选填:放热、吸热).
(2)在800℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有________(选填A、B、C、D、E).
| A | B | C | D | E |
| n(CO2) | 3 | 1 | | 1 | 1 |
| n(H2) | 2 | 1 | | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
(3)已知在一定温度下:C(s)+CO2(g)  2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s)+H2O(g)  CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2,
H2(g)+CO2(g) 平衡常数K2,
则K、K1、K2之间的关系是:________.
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为:________.
(5)若在800℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y=________.
(6)在VL密闭容器中通入10molCO和10mol水蒸气,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧热为283kJ/mol,H2燃烧热为286kJ/mol),则T℃平衡常数K=________.
-
煤化工中常需研究不同温度下平衡常数、投料比及热值等问题.
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如表:
H2(g)+CO2(g)的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数Kc | 9.94 | 9 | 1 |
试回答下列问题:
(1)上述正向反应是:________ 反应(选填:放热、吸热).
(2)在800℃发生上述反应,以下表中的物质的量投入恒容反应器,其中向正反应方向移动的有________(选填A、B、C、D、E).
| A | B | C | D | E |
| n(CO2) | 3 | 1 | | 1 | 1 |
| n(H2) | 2 | 1 | | 1 | 2 |
| n(CO) | 1 | 2 | 3 | 0.5 | 3 |
| n(H2O) | 5 | 2 | 3 | 2 | 1 |
(3)已知在一定温度下:C(s)+CO2(g)  2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s)+H2O(g)  CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g) H2(g)+CO2(g) 平衡常数K2,
H2(g)+CO2(g) 平衡常数K2,
则K、K1、K2之间的关系是:________.
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为:________.
(5)若在800℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为x;平衡时CO转化率为y,则y随x变化的函数关系式为:y=________.
(6)在VL密闭容器中通入10molCO和10mol水蒸气,在T℃达到平衡,然后急速除去水蒸气(除水蒸气时各物质的物质的量不变),将混合气体燃烧,测得放出的热量为2842kJ(已知CO燃烧热为283kJ/mol,H2燃烧热为286kJ/mol),则T℃平衡常数K=________.
-
煤化工生产中常研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g)+H2O(g)  H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
则下列说法错误的是 ( )
A.在830℃,等物质的量的CO和H2O反应达到平衡时,CO的转化率为50%
B.上述正向反应是放热反应
C.某温度下上述反应平衡时,恒容、升高温度,原化学平衡向逆反应方向移动
D.在500℃时,反应达到平衡后,增大压强,化学平衡常数K减小
-
煤化工生产中常需研究不同温度下平衡常数、投料比及产率等问题.
已知:CO(g)+H2O(g)⇌H2(g)+CO2(g)的平衡常数随温度的变化如表:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
则下列说法错误的是( )
A.在830℃,等物质的量的CO和H2O反应达到平衡时,CO的转化率为50%
B.上述正向反应是放热反应
C.某温度下上述反应平衡时,恒容、升高温度,原化学平衡向逆反应方向移动
D.在500℃时,反应达到平衡后,增大压强,化学平衡常数K减小
-
(11分)煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数随温度的变化如下表:
CO2(g)+H2(g)的平衡常数随温度的变化如下表:
| 温度/℃ | 400 | 500 | 830 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
试回答下列问题
(1)上述反应的正反应是________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率________(填“增大”、“减小”或“不变”),容器内混合气体的压强(填“增大”、“减小”或“不变”)。
(3)830℃,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有________(选填A、B、C、D)。
| A | B | C | D |
| n(CO2) | 3 | 1 | 0 | 1 |
| n(H2) | 2 | 1 | 0 | 1 |
| n(CO) | 1 | 2 | 3 | 0.5 |
| n(H2O) | 5 | 2 | 3 | 2 |
(4)830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是________。


