-
(12分)甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。

(1)B中反应的离子方程式是_ ___。
(2)A中溶液变红的原因是__ __。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应。
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN-的电子式为
①甲同学认为SCN-中碳元素没有被氧化,理由是 。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是 。
③通过实验证明了SCN-中氮元素转化为NO3-。
④若SCN-与Cl2反应生成1 mol CO2,则转移电子的物质的量是 mol。
-
(14分)甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。

(1)B中反应的离子方程式是____。
(2)A中溶液变红的原因是____。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象Ⅱ的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为
①甲同学认为SCN—中碳元素没有被氧化,理由是 。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是 。
③通过实验证明了SCN—中氮元素转化为NO3-,他的实验方案是____。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是 mol。
-
Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。

(1)B中反应的离子方程式是 .
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaO H溶液,有红褐色沉淀生成,则溶液中一定存在________ .
H溶液,有红褐色沉淀生成,则溶液中一定存在________ .
(3)资料显示:SCN -的电子式为  .甲同学猜想SCN― 可能被Cl2氧化了,他进行了如下研究.
.甲同学猜想SCN― 可能被Cl2氧化了,他进行了如下研究.
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN― 中被氧化的元素是 .
②甲同学通过实验证明了SCN― 中氮元素转化为NO3― ,已知SCN― 中碳元素没有被氧化,若SCN― 与Cl2反应生成1mol CO2,则转移电子的物质的量是 mol.
Ⅱ.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
(1) 写出NaCN的电子式__________,偏碱性条件下,氰化钠溶液的CN― 被双氧水氧化为HCO3― ,同时放出NH3,该反应的离子方程式:________ 。
(2)Cu2+可作为双氧水氧化CN― 中的催化剂。某兴趣小组要探究Cu2+对双氧水氧化CN― 是否起催化作用,请你完成下实验方案。填写实验步骤、实验现象和结论(己知:CN― 浓度可用离子色谱仪测定)
| 步骤:分别取等体积、等浓度的含氰废水于甲、乙两支试管中,________________________________ ___________________________________________ ___________________________________________ __________________________________________ | 现象与结论: 若____________________________ _______________________________ 若____________________________ _______________________________ |
-
(16分)
Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
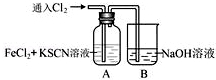
(1)B中反应的离子方程式是 .
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在________ .
(3)资料显示:SCN -的电子式为 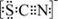 .甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
.甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN﹣中被氧化的元素是 .
②甲同学通过实验证明了SCN﹣中氮元素转化为NO3﹣,已知SCN﹣中碳元素没有被氧化,若SCN﹣与Cl2反应生成1mol CO2,则转移电子的物质的量是 mol.
Ⅱ.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
(1)写出NaCN的电子式__________,偏碱性条件下,氰化钠溶液的CN﹣被双氧水氧化为HCO3﹣,同时放出NH3,该反应的离子方程式:_______ 。
(2)Cu2+可作为双氧水氧化CN﹣中的催化剂。某兴趣小组要探究Cu2+对双氧水氧化CN﹣是否起催化作用,请你完成下实验方案。填写实验步骤、实验现象和结论(己知:CN﹣浓度可用离子色谱仪测定)
| 步骤:分别取等体积、等浓度的含氰废水于甲、乙两支试管中,________________________________ ___________________________________________ ___________________________________________ __________________________________________ | 现象与结论: 若____________________________ _______________________________ 若____________________________ ____________________ |
-
Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
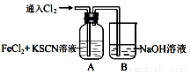
(1)B中反应的离子方程式是 ;
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验。取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 ;
(3)资料显示:SCN -的电子式为 。甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究。
。甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究。
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN﹣中被氧化的元素是 ;
②甲同学通过实验证明了SCN﹣中氮元素转化为NO3﹣,已知SCN﹣中碳元素没有被氧化,若SCN﹣与Cl2反应生成1mol CO2,则转移电子的物质的量是 mol;
Ⅱ.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
请写出NaCN的电子式___________,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3﹣,同时放出NH3,该反应的离子方程式为 。
-
甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
| 操 作 | 现 象 |
| 
| I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
(1)B中反应的离子方程式是 。
(2)A中溶液变红的原因是 。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象II的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为  。
。
① 甲同学认为SCN—中碳元素没有被氧化,理由是 。
② 取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是 。
③ 通过实验证明了SCN—中氮元素转化为NO3-,他的实验方案是 。
④ 若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是______mol。
-
(15分)甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.
| 操 作 | 现 象 |
| 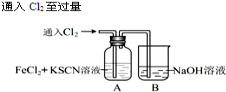
| I.A中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
(1)B中反应的离子方程式是 .
(2)A中溶液变红的原因是 .
(3)为了探究现象Ⅱ的原因,甲同学进行如下实验.①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 .②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。甲同学的实验证明产生现象Ⅱ的原因是SCN﹣与Cl2发生了反应.
(4)甲同学猜想SCN﹣可能被Cl2氧化了,他又进行了如下研究.资料显示:SCN﹣的电子式为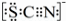 。
。
①甲同学认为SCN﹣中碳元素没有被氧化,理由是 。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,此证明SCN﹣ 中被氧化的元素是 .
③通过实验证明了SCN﹣中氮元素转化为NO3﹣,他的实验方案是 .
④若SCN﹣与Cl2反应生成1mol CO2,写出反应离子方程式 并计算转移电子的物质的量是 mol。
-
甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
| 操作 | 现象 |
| 通入氯气至过量 
| I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
(1)B中反应的离子方程式是 。
(2)A中溶液变红的原因是 。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象II的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为  。
。
①甲同学认为SCN—中碳元素没有被氧化,理由是 。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是 。
③通过实验证明了SCN- 中氮元素转化为NO3-,他的实验方案是 。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是 mol。
-
(14分)甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
| 操 作 | 现 象 |
| 通入氯气至过量 
| I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
(1)B中反应的离子方程式是______。
(2)A中溶液变红的原因是______。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_______。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象II的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为  。
。
①甲同学认为SCN—中碳元素没有被氧化,理由是______。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是______。
③通过实验证明了SCN—中氮元素转化为,他的实验方案是______。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是______mol。
-
Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
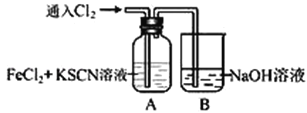
(1)B中反应的离子方程式是________________________________________________。
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在__________________。
(3)资料显示:SCN -的电子式为  。甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是__________________。
。甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究。①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是__________________。
②甲同学通过实验证明了SCN―中氮元素转化为NO3― ,已知SCN―中碳元素没有被氧化,若SCN―与Cl2反应生成0.5mol CO2,则转移电子的物质的量是_______________mol。
Ⅱ. 8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
(1)写出NaCN的电子式__________,偏碱性条件下,氰化钠溶液的CN― 被双氧水氧化为HCO3―,同时放出NH3,该反应的离子方程式:____________________________________。
(2)已知CN-离子、SCN-离子和Cl-离子有相似之处,氰分子(CN)2和硫氰分子(SCN)2的性质与Cl2也有相似之处,且常温常压均为气体,完成下列反应方程式:
①MnO2和HSCN的浓溶液共热的化学方程式方式为____________________________。
②(CN)2和NaOH溶液反应的离子反应方程式为_____________________________________。
。




 .甲同学猜想SCN― 可能被Cl2氧化了,他进行了如下研究.
.甲同学猜想SCN― 可能被Cl2氧化了,他进行了如下研究.
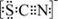 .甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.
.甲同学猜想SCN﹣可能被Cl2氧化了,他进行了如下研究.


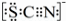 。
。
 。
。