-
试运用所学知识,解决下列问题:
(1)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)  H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下表所示:
| 温度/°C | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol•L-1,在该条件下,CO的平衡转化率为______.
(2)在100℃时,将0.40mol的二氧化氮气体充入2L抽真空的密闭容器中,每隔一定时间就对该容器内的物质进行分析,得到如下表数据:
| 时间/s | | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
①n3______n4(填“>”或“<”或“=”),该反应的平衡常数的值为______;
②若在相同情况下最初向该容器充入的是四氧化二氮气体,要达到上述同样的平衡状态,四氧化二氮的起始浓度是______mol•L-1,假设在80s时达到平衡,请在右图中画出并标明该条件下此反应中N2O4和NO2的浓度随时间变化的曲线.
(3)以甲醇为燃料制成燃料电池,请写出在氢氧化钾介质中该电池的正极反应式______.
-
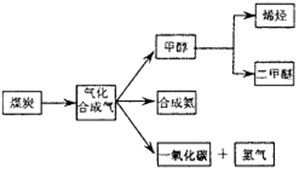
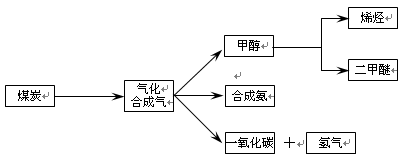
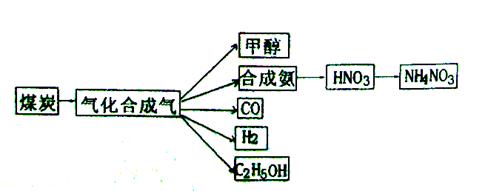
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡常数表达式为:
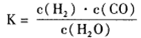
它所对应反应的化学方程式为_______。
已知在一定温度下,在同一平衡体系中各反应及平衡常数如下:
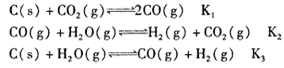
则K1、K2、K3之间的关系为_______。
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应: , 该反应平衡常数随温度的变化如下:
, 该反应平衡常数随温度的变化如下:

该反应的逆反应方向是_______反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时CO的转化率为_______。
(3)甲醇是一种新型的汽车动力燃料,可通过CO和H2化合制备甲醇,该反应的热化学方程式为: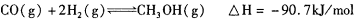
下列描述中能说明上述反应已达平衡的是_______;
A. 容器内气体的平均摩尔质量保持不变
B. 
C. 容器中气体的压强保持不变
D. 单位时间内生成n molCO的同时生成2n mol H2
(4)甲醇-空气燃料电池(DMFC)是一种高效能、轻污 染电动汽车的车载电池,其工作原理如下图所示,该燃料电池的电池反应式为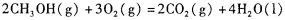 ,则负极的电极反应式为_______。
,则负极的电极反应式为_______。
(5) CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其 。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀。现将CaCl2溶液与
。 CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀。现将CaCl2溶液与 的Na2CO3溶液等体积混合,则生成沉淀时原CaCl2溶液的最小浓度为_______。
的Na2CO3溶液等体积混合,则生成沉淀时原CaCl2溶液的最小浓度为_______。
-
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡表达式为:K=
它所对应反应的化学方程式为。
已知在一定温度下,在同一平衡体系中各反应的平衡常数如下:
C(s)+CO2(g)  2CO(g),K1
2CO(g),K1
CO(g)+H2O(g)  H2(g)+CO2(g),K2
H2(g)+CO2(g),K2
C(s)+H2O(g)  CO(g)+H2(g),K3
CO(g)+H2(g),K3
则K1、K2、K3之间的关系为。
(2)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,发生如下反应:CO(g)+H2O(g) H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
该反应的逆反应方向是 反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时CO的转化率为。
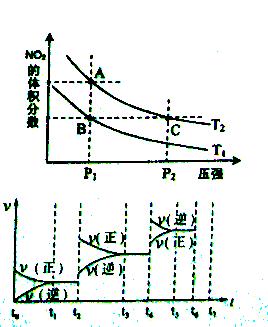
(3)对于反应N2O4(g) 2NO2(g)-Q(Q>0),在温度
2NO2(g)-Q(Q>0),在温度
为T1、T2时,平衡体系中NO2的体积分数随压强变化
曲线如图所示。下列说法正确的是 ________ 。
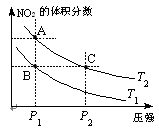
A.两种不同的温度比较:T1 > T2
B.A、C两点的反应速率:A<C
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法实现
(4)如右图,采用NH3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率,反应原理为:NO(g) + NO2(g) + 2NH3(g)  2N2(g) + 3H2O(g)
2N2(g) + 3H2O(g)

以下说法正确的是(注:脱氮率即氮氧化物转化率)
A.上述反应的正反应为吸热反应
B.相同条件下,改变压强对脱氮率没有影响
C.曲线①、②最高点表示此时平衡转化率最高
D.催化剂①、②分别适合于250℃和450℃左右脱氮
-
(14分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
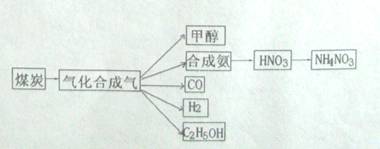
(1)已知该产业链中某反应的平衡表达式为:K= ,它所对应的化学反应为:________
,它所对应的化学反应为:________
(2)已知在一定温度下,各反应的平衡常数如下:
C(s)+C02(g)  2C0(g),K1 ①
2C0(g),K1 ①
CO(g)+H20(g)  H2(g)+C02(g),K2 ②
H2(g)+C02(g),K2 ②
C(s)+H20(g)  CO(g)+H2(g),K3 ③
CO(g)+H2(g),K3 ③
则K1、K2、K3,之间的关系是: ,反应①的平衡常数K随温度的升高而 ________ ________(增大/减小/不变)。
一定温度下,在三个容积均为2L的容器中均进行着③反应,各物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。

简述理由:
(3)该产业链中氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如N0、N02、N204等。对反应N2O4(g)  2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
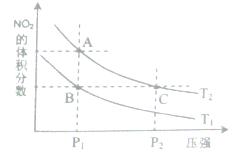
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
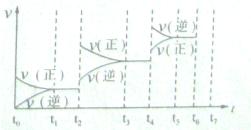
(4)如果(3)中的反应达到平衡后,改变某一外界条件(不改变N204、N02的量),反应速率v与时间t关系如图所示。图中t4时引起平衡移动的条件可能是________ ;图中表示平衡混合物中N02的含量最高的一段时间是________。
-
(14分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡表达式为:K=
它所对应的化学反应为: ________
(2)已知在一定温度下,各反应的平衡常数如下:
C(s)+C02(g)  2C0(g) △H>O,K1 ①
2C0(g) △H>O,K1 ①
CO(g)+H20(g)  H2(g)+C02(g),K2 ②
H2(g)+C02(g),K2 ②
C(s)+H20(g)  CO(g)+H2(g),K3 ③
CO(g)+H2(g),K3 ③
则K1、K2、K3,之间的关系是: 。
反应①的平衡常数K随温度的升高而 (增大/减小/不变)。
一定温度下,在三个容积均为2L的容器中均进行着③反应,各物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。

简述理由:
(3)该产业链中氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如N0、N02、N204等。对反应N2O4(g)  2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
2N02(g) △H>O,在温度为T1、T2时,平衡体系中N02的体积分数随压强变化曲线如图所示。下列说法正确的是( )
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(4)如果(3)中的反应达到平衡后,改变某一外界条件(不改变N204、N02的量),反应速率v与时间t关系如右图所示。图中t4时引起平衡移动的条件可能是________ ;图中表示平衡混合物中N02的含量最高的一段时间是________。
-
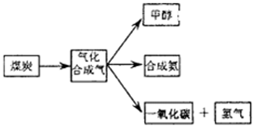
如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
(1)已知该产业链中某反应的平衡常数表达式为:K= ,它所对应反应的化学方程式是________.
,它所对应反应的化学方程式是________.
(2)合成甲醇的主要反应是:2H2(g)+CO(g)⇌CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160.此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
①该时间段内反应速率v(H2)=________
②比较此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”)
③反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡向________(填“逆向”、“正向”或“不”)移动,平衡常数K________(填“增大”、“减小”或“不变”).
(3)固氮是科学家致力研究的重要课题.自然界中存在天然的大气固氮过程:N2(g)+O2(g)→2NO (g)-180.8kJ,工业合成氨则是人工固氮.
分析两种固氮反应的平衡常数,下列结论正确的是________.
| 反应 | 大气固氮 | 工业固氮 |
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
A.常温下,大气固氮很难进行,而工业固氮却能非常容易进行
B.模拟大气固氮应用于工业上的意义不大
C.工业固氮时温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大.
-
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
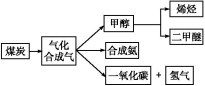
Ⅰ.已知该产业链中某反应的平衡常数表达式为:K= ,写出它所对应反应的化学方程式:________
,写出它所对应反应的化学方程式:________
。
Ⅱ.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用。工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0 MPa,温度230~280 ℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
ΔH1=-90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
ΔH2=-23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
ΔH3=-41.2 kJ·mol-1
(1)写出催化反应室中三个反应的总反应的热化学方程式: 。
(2)在某温度下,2 L密闭容器中发生反应①,起始时CO、H2的物质的量分别为2 mol和6 mol,3 min后达到平衡,测得CO的转化率为60%,则3 min内CO的平均反应速率为 。若同样条件下起始时CO物质的量为4 mol,达到平衡后CH3OH为2.4 mol,则起始时H2为 mol。
(3)下列有关反应③的说法正确的是 。
A.在体积可变的密闭容器中,在反应③达到平衡后,若加压,则平衡不移动、混合气体平均相对分子质量不变、混合气体密度不变
B.若830 ℃时反应③的K=1.0,则在催化反应室中反应③的K>1.0
C.某温度下,若向已达平衡的反应③中加入等物质的量的CO和H2O(g),则平衡右移、平衡常数变大
(4)为了寻找合适的反应温度,研究者进行了一系列实验,每次实验保持原料气组成、压强、反应时间等因素不变,实验结果如图,
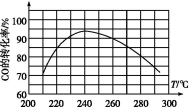
则CO转化率随温度变化的规律是________ 。
其原因是 。
-
下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:

I.已知该产业链中某反应的平衡表常数达式为:K= ,它所对应反应的化学方程式为 。
,它所对应反应的化学方程式为 。
II.二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ·mol-1
CH3OH(g) △H1=-90.7kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)催化反应室中总反应的热化学方程式为 。
830℃时反应③的K=1.0,则在催化反应室中反应③的K 1.0(填“>”、“<”或“=”)。
(2)在某温度下,若反应①的起始浓度分别为:c(CO)=1 mol/L,c(H2)=2.4 mol/L,5 min后达到平衡,CO的转化率为50%;若反应物的起始浓度分别为:c(CO)=4 mol/L,c(H2)=a mol/L,达到平衡后,c(CH3OH)=2 mol/L,则a= mol/L。
(3)反应②在t℃时的平衡常数为400,此温度下,在0.5L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| c(mol/L) | 0.8 | 1.24 | 1.24 |
①此时刻v正 v逆(填“大于”“小于”或“等于”)
②平衡时二甲醚的物质的量浓度是 。
(4)以二甲醚、空气、KOH 溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为 ;若以1.12L/min(标准状况)的速率向电池中通入二甲醚,用该电池电解500mL2mol/L CuSO4溶液,通电0.50 min后,计算理论上可析出金属铜的质量为 。
-
如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:

(1)已知该产业链中某反应的平衡常数表达式为: ,它所对应反应的化学方程式是
,它所对应反应的化学方程式是
_________________________________。
(2)合成甲醇的主要反应是:2H2(g)+CO(g) CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
CH3OH(g)+90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
①该时间段内反应速率v(H2)=________
②比较此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”)
③反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡向________(填“逆向”、“正向”或“不”)移动,平衡常数K________(填“增大”、“减小” 或“不变”)。
(3)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:N2 (g) + O2 (g) →2NO (g) -180.8 kJ,工业合成氨则是人工固氮。分析两种固氮反应的平衡常数,下列结论正确的是________。
| 反应 | 大气固氮 | 工业固氮 |
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
A.常温下,大气固氮很难进行,而工业固氮却能非常容易进行
B.模拟大气固氮应用于工业上的意义不大
C.工业固氮时温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大
-
(16分)下图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
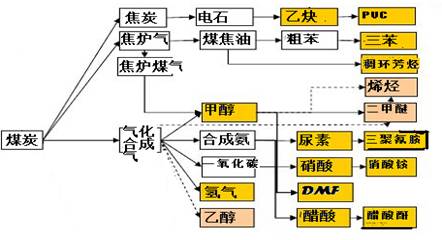
(1)该产业链中合成氨的反应在较低温下能否自发进行? 。
(2)已知该产业链中某反应的平衡表达式为:
它所对应的化学反应为: 。
(3)已知在一定温度下,各反应的平衡常数如下:
C(s)+CO2(g)  2CO(g),K1
2CO(g),K1
CO(g)+H2O(g  H2(g)+CO2(g), K2
H2(g)+CO2(g), K2
C(s)+H2O(g) CO(g)+H2(g) ,K3
CO(g)+H2(g) ,K3
则K1、K2、K3之间的关系是: 。
(4)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题。已知等体积的一氧化碳和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)  H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
H2(g)+CO2(g),该反应平衡常数随温度的变化如下:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
该反应的正反应方向是反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的起始浓度均为0.020mol/L,在该条件下,CO的平衡转化率为: 。
(5)从图中看出氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等。已知NO2和N2O4的结构式分别是 和
和 。已知N-N键键能为167kJ·mol-1,NO2中氮氧键的键能为466kJ·mol-1,N2O4中氮氧键的键能为438.5kJ·mol-1。请写出NO2转化为N2O4的热化学方程式为 。
。已知N-N键键能为167kJ·mol-1,NO2中氮氧键的键能为466kJ·mol-1,N2O4中氮氧键的键能为438.5kJ·mol-1。请写出NO2转化为N2O4的热化学方程式为 。
对反应N2O4(g)  2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。
2NO2(g),在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。

下列说法正确的是 。
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态B到状态A,可以用加热的方法
(6)以上述产业链中甲醇为燃料制成燃料电池,请写出在氢氧化钾介质中该电池的负极反应式 ________ 。


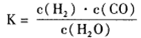
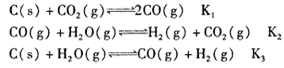
 , 该反应平衡常数随温度的变化如下:
, 该反应平衡常数随温度的变化如下:
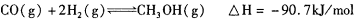
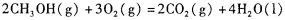 ,则负极的电极反应式为_______。
,则负极的电极反应式为_______。












 ,写出它所对应反应的化学方程式:________
,写出它所对应反应的化学方程式:________




