-
氮元素能够形成多种化合物。请回答下列问题:
(1)联氨(N2H4)常温下为液态,在空气中迅速完全燃烧生成N2,同时大量放热,可作导弹、宇宙飞船、火箭的燃料。
已知:H2 (g)+1/2 O2(g) = H2O(l) △H1= —285.8kJ/mol
N2(g)+2H2(g) = N2H4(l) △H2= + 50.6kJ/mol
则N2H4(l)在空气燃烧生成液态水的热化学方程式为_______________________。
(2)利用氨气生产氢氰酸(HCN)的反应CH4(g)+NH3 (g)=HCN(g)+3H2(g) △H>0
①一定温度下,向2L恒容容器中充入1mol CH4(g)和2mol NH3(g)发生上述反应,4min达到平衡时,测得CH4平衡转化率为66.67%, 0~4min内,用H2表示的该反应速率v (H2) =___________。保持温度和容积不变,再向平衡后的容器中充入2mol NH3和2molH2,此时v正 ___v逆(选填“>”“<”或“=”)。
②平衡体系中HCN的物质的量(n) 随某物理量变化曲线如图所示(图中x、L分别表示温度或压强)。

若x为温度,则曲线,____ (选填“L1”或“L2”)能正确表示n (HCN) 与温度的关系;
若x为压强,则曲线____ (选填“L1”或“L2”)能正确表示n ( HCN)与压强的关系。
(3)NH3 能够形成Ag(NH3)2+。
已知溶液中存在Ag+ (aq)+2NH3 (aq)==Ag( NH3)2+(aq ),常温下该反应平衡常数K1=1.10×107,反应AgCl (s)+2NH3 (aq)  Ag( NH3)2+(aq) +Cl-(aq)的化学平衡常数K2=1.936×10-3,则Ksp(AgCl)=____________。
Ag( NH3)2+(aq) +Cl-(aq)的化学平衡常数K2=1.936×10-3,则Ksp(AgCl)=____________。
(4)硫氧化物和氮氧化物是常见的大气污染物,利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。
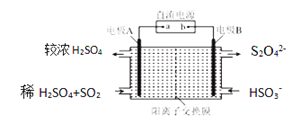
①电极A的电极反应式为__________________________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应离子方程式为________________________________。
-
氮元素能够形成多种化合物。请回答下列问题:
 联氨
联氨 常温下为液态,在空气中迅速完全燃烧生成
常温下为液态,在空气中迅速完全燃烧生成 ,同时放出大量热,可作导弹、宇宙飞船、火箭的燃料。
,同时放出大量热,可作导弹、宇宙飞船、火箭的燃料。
已知: 的燃烧热为
的燃烧热为
 ;
;
 ;
;
则 在空气中燃烧生成气态水的热化学方程式为______。
在空气中燃烧生成气态水的热化学方程式为______。
 工业上利用氨气生产氢氰酸
工业上利用氨气生产氢氰酸 的反应为
的反应为
 。
。
 一定温度下,向2L恒容容器中充入1mol
一定温度下,向2L恒容容器中充入1mol  和2mol
和2mol  发生上述反应,8min达到平衡时,测得
发生上述反应,8min达到平衡时,测得 的转化率为
的转化率为 ,
, 内,用
内,用 表示的该反应速率v
表示的该反应速率v  ______。
______。
保持温度和容积不变,再向平衡后的容器中充入 
 和
和 HCN,此时
HCN,此时 ______
______ 选填“
选填“ ”“
”“ ”或“
”或“ ”
” 。
。
 在
在 下,将a
下,将a  的NaCN溶液与
的NaCN溶液与 的盐酸等体积混合,反应后测得溶液
的盐酸等体积混合,反应后测得溶液 ,则a______
,则a______ 填“
填“ ”、“
”、“ ”或“
”或“ ”
” ;用含a的代数式表示HCN的电离常数
;用含a的代数式表示HCN的电离常数 ______。
______。
 能够和
能够和 形成
形成 。
。
 溶液中存在
溶液中存在



 时,其平衡常数的表达式为
时,其平衡常数的表达式为 ______。
______。
 常温下,
常温下, ,反应AgCl
,反应AgCl 


 的化学平衡常数
的化学平衡常数 ,则
,则 ______。
______。
 高剂量的亚硝酸盐有很大毒性,电化学降解
高剂量的亚硝酸盐有很大毒性,电化学降解 的原理如图:
的原理如图:

 阴极反应式为______。
阴极反应式为______。
 若电解过程中转移了3mol电子,则膜两侧电解液的质量变化差
若电解过程中转移了3mol电子,则膜两侧电解液的质量变化差 为______g。
为______g。
-
氮元素能够形成多种化合物。请回答下列问题:
(1)联氨(N2H4)常温下为液态,在空气中迅速完全燃烧生成N2,同时放出大量热,可作导弹、宇宙飞船、火箭的燃料。
已知:H2(g)+1/2O2(g)==H2O(l);△H1=-285.8kJ/mol
N2(g)+2H2(g)=N2H4(l);△H2=+50.6kJ/mol
则N2H4(l)在空气燃烧生成液态水的热化学方程式为_____________。
(2)工业上利用氨气生产氢氰酸(HCN)的反应为CH4(g)+NH3(g) HCN(g)+3H2(g) △H>0。
HCN(g)+3H2(g) △H>0。
①一定温度下,向2L恒容容器中充入1mol CH4(g)和2mol NH3(g)发生上述反应,4min达到平衡时,测得CH4的转化率为66.67%。0~4min內,用H2表示的该反应速率v(H2)=_____。
保持温度和容积不变,再句平衡后的容器中充入2molNH3和2molH2,此时v正___v逆(选填“>”“<”或“=”)。
②平衡体系中HCN的物质的量(n)随某物理量变化曲线如图所示(图中x、L分别表示温度或压强)。

若x为温度,则曲线,____(选填“L1”或“L2”)能正确表示n (HCN) 与温度的关系;
若x为压强,则曲线____(选填“L1”或“L2”)能正确表示n HCN)与压强的关系。
(3)NH3能够形成Ag(NH3)2+。
①溶液中存在Ag+ (aq)+2NH3 (aq)==Ag( NH3)2+(aq )时,其平衡常数的表达式为K稳=_______。
②常温下,K稳[Ag(NH3)2+]=1.10×107,反应AgCl (s)+2NH3 (aq) Ag( NH3)2+(aq) +Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=_____。
Ag( NH3)2+(aq) +Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=_____。
(4)硫氧化物和氮氧化物是常见的大气污染物,利用如图所示发置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。

①电极A的电极反应式为______________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体。同时有SO32-生成。该反应离子方程式为______________。
-
氮元素能够形成多种化合物。请回答下列问题:
(1)联氨(N2H4)在空气中迅速完全燃烧生成N2,同时放大量热,可作火箭的燃料。
已知:H2 (g)+1/2 O2(g)==H2O(g) △H1=-241.8kJ/mol
N2(g)+2H2(g)=N2H4(l) △H2=+50.6kJ/mol
H2O(g)= H2O(l) △H3=-44kJ/mol
则N2H4(l)在空气燃烧生成N2和气态水的热化学方程式为________________________。
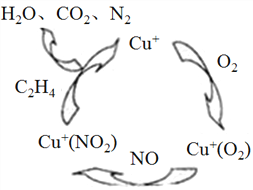
(2)汽车尾气中的氮氧化物是形成酸雨的气体之一,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图。写出该脱硝原理总反应的化学方程式:___________________________。
(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)  N2(g)+CO2(g) ΔH= a kJ/mol
N2(g)+CO2(g) ΔH= a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
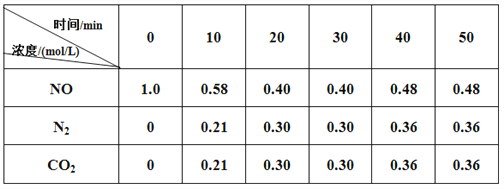
根据图表数据分析T1℃时:
①该反应在0-20min的平均反应速率v(NO)= _________ ;
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是 _________(填字母)。
A.通入一定量的CO2
B.加入合适的催化剂
C.适当缩小容器的体积
D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则a _____0(填“>”或“<”)。
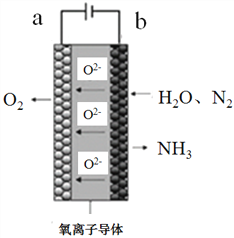
(4)电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。下图是一种电解法合成氨的装置图。则b电极上的电极反应式为__________________________。
(5)AgCl能溶于氨水,发生反应AgCl (s)+2NH3 (aq)  Ag( NH3)2+(aq) +Cl-(aq),其平衡常数K=1.936×10-3。现用1L某浓度氨水(溶质视为NH3)完全溶解0.1molAgCl,所需氨水浓度至少为________。(写出表达式即可)
Ag( NH3)2+(aq) +Cl-(aq),其平衡常数K=1.936×10-3。现用1L某浓度氨水(溶质视为NH3)完全溶解0.1molAgCl,所需氨水浓度至少为________。(写出表达式即可)
-
(12分)氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1g燃料完全燃烧释放出的能量为42.5kJ,则该反应的热化学方程式为 。
(2)25℃时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=−a kJ/mol(a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g) ΔH=−a kJ/mol(a>0)。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:

①25℃时,该反应的平衡常数为 ;
②下列情况不是处于平衡状态的是 :
a.混合气体的密度保持不变;
b.混合气体的颜色不再变化;
c.气压恒定时。
③若反应在120℃进行,某时刻测得n(NO2)=0.6 mol n(N2O4)=1.2mol,则此时v(正) v(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol/L NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点。

①b点时,溶液中发生水解反应的离子是 ;
②在c点,溶液中各离子浓度由大到小的排列顺序是 。
-
(16分)氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,则该反应的热化学方程式为 。
(2)298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
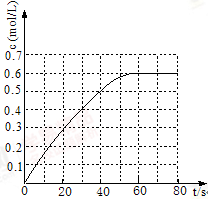
①298k时,该反应的平衡常数为 L ·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
A.混合气体的密度保持不变; B.混合气体的颜色不再变化; C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol n(N2O4)=1.2mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
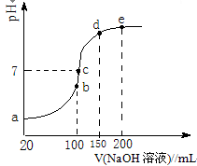
试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序是 。
-
(16分)氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,则该反应的热化学方程式为 。
(2)298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0)
N2O4(g) ΔH=-a kJ·mol-1 (a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时, N2O4的浓度为NO2的2倍,回答下列问题:
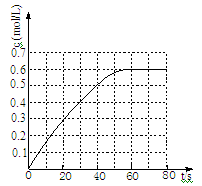
①298k时,该反应的平衡常数为 L ·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
a.混合气体的密度保持不变;
b.混合气体的颜色不再变化;
c.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol n(N2O4)=1.2mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
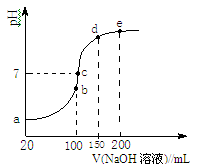
试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序是 。
-
(11分)氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,该反应的热化学方程式为 。
(2)298 K时,在固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
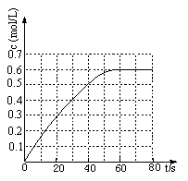
①298k时,该反应的平衡常数为 L ·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
a.混合气体的密度保持不变;
b.混合气体的颜色不再变化;
c.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)=0.3 mol·mol-1,n(N2O4)=0.6 mol·mol-1,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
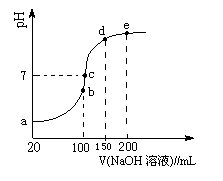
试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序是 。
-
氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5 kJ,则该反应的热化学方程式为 。
(2)298 K时,在2 L固定体积的密闭容器中,发生可逆反应:
2NO2(g) N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
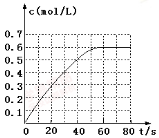
① 298k时,该反应的平衡常数为 L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)=0.6 mol,n(N2O4)=1.2 mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。
现向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
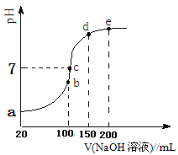
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序 。
③d、e点对应溶液中,水电离程度大小关系是d e(填“>”、“<”或“=”)。
-
氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5 kJ,则该反应的热化学方程式为_________。
(2)298 K时,在2 L固定体积的密闭容器中,发生可逆反应:
2NO2(g) N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:

① 298k时,该反应的平衡常数为_____L·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是______:
A.混合气体的密度保持不变;
B.混合气体的颜色不再变化;
C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol,n(N2O4)="1.2" mol,则此时V(正)___V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。
现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d、e五个点,
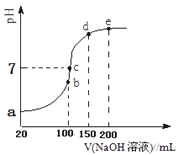
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序___________。
③d、e点对应溶液中,水电离程度大小关系是d______e(填“>”、“<”或“=”)。
HCN(g)+3H2(g) △H>0。

Ag( NH3)2+(aq) +Cl-(aq)的化学平衡常数K=1.936×10-3,则Ksp(AgCl)=_____。


















