-
有A、B、C、D、E、F六种前四周期元素,它们的原子序数依次增大。A、D同主族,A元素的原子最外层p能级的电子数等于次外层的电子总数,C原子最外层中有两个未成对的电子且与A同周期;C元素可分别与A、B、D、E生成RC2型化合物,并知EC2中E与C的质量比为1/1;F能形成红色(或砖红色)和黑色的两种氧化物。根据以上条件,回答下列问题:
(1)请写出F元素的名称 ___________F元素电子排布式___________________________
(2)在EC2分子中,E原子的杂化轨道类型为_________,分子的空间构型为 _______;
(3)H2E和H2C2的主要物理性质比较如下:
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 |
| H2E | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
H2E和H2C2的相对分子质量基本相同,造成上述几种物理性质差异的主要原因 _____________ 。
(4)元素A的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 (_______________)
A.分子中含有分子间氢键 C.只含有4个sp-s的σ键和1个p-p的π键
B.属于含有极性键的非极性分子 D.该氢化物分子中A原子采用sp2杂化
(5)B和F形成某种化合物的晶胞结构如右图所示(每个球均表示1个原子,其中B显-3价),则其化学式为 __________。F的常见离子和B的最简单氢化物形成的配离子的名称为___________,其水溶液颜色为________________。


-
(9分).有A、B、C、D、E五种短周期元素,其中A、C、B属于同一周期,且原子序数依次增大;A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有两个不成对的电子;D、E原子核内各自的质子数与中子数相等;B元素可分别与A、C、D、E生成RB2型化合物,并知在DB2和EB2中,D与B的质量比为7∶8,E与B的质量比为1∶1。试回答:
(1)写出D元素基态原子的电子排布式:____________________________________。
(2)写出AB2的路易斯结构式为:__________________。
(3)B、C两元素的第一电离能大小关系为________>________(填元素符号)。
(4)根据VSEPR模型预测C的氢化物的立体结构为________,中心原子C的轨道杂化类型为________。
(5)C的单质分子中π键的数目为________,B、D两元素的气态氢化物的稳定性大小关系为________>________(填化学式)。
-
A、 B、C、D、E、F、G为原子序数依次增大的前四周期元素。A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级。且每个能级上排布的电子数相同;A与C形成的最简单分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对。E与F同周期;G的原子序数等于A、C、D、F四种元素原子序数之和。
(1)写出B的基态原子的核外电子排布图________;回答E与F原子的第一电离能的大小关系怎样 ______________。原因是_____________________________________;
(2)C3-是一种弱酸根离子,请写出两种与C3-互为等电子体的分子的化学式_______,________;
(3)A与D形成的A2D2分子中D原子的杂化类型为_________杂化,A与C形成的最简单分子易溶于水的原因____________________________;
(4)G的晶体中原子按_________(填“ABABAB”或“ABCABCABC”)的方式堆积而成,G的晶体堆积模型名称______________________;
(5) G的晶体中G原子的配位数为_________ ,空间利用率为__________________;
(6)元素G的一种氯化物的晶胞如图所示,该氯化物的化学式,两种微粒间最短距离为460.0 pm,晶体密度为________g/cm3。(列式表示)
 .
.
-
元素A、B、C、D、E、F、G的原子序数依次增大,A、F原子的最外层电子数等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同的能级,且每个能级上排布的电子数相等;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F;G原子最外层有一个单电子,且内层原子轨道均排满。
(1)与C单质分子互为等电子体的分子为_____,该分子的电子式为______________。
(2)B、C、D三种元素第一电离能从大到小的顺序:________(填元素符号)
(3)光谱证实:单质F与强碱性溶液反应有[F(OH)4]-生成,则[F(OH)4]-中存在_________。
a、共价键 b、非极性键 c、配位键 d、σ键 e、π键
(4)B、C、D三种元素与A形成的最简单化合物的稳定性由强到弱的顺序:____(填化学式)
(5)G位于元素周期表的____区,向含有G2+离子的溶液中通入A、C形成的最简单分子至过量所涉及的两个离子方程式_________________________________________________。
-
元素A、B、C、D、E、F、G的原子序数依次增大,A、F原子的最外层电子数等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同的能级,且每个能级上排布的电子数相等;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F;G原子最外层有一个单电子,且内层原子轨道均排满。
(1)与C单质分子互为等电子体的分子为________,该分子的电子式为______________。
(2)B、C、D、E、F五种元素第一电离能从大到小的顺序:____________(填元素符号)
(3)光谱证实:单质F与强碱性溶液反应有[F(OH)4]-生成,则[F(OH)4]-中存在_________。
a、共价键 b、非极性键 c、配位键 d、σ键 e、π键
(4)B、C、D三种元素与A形成的最简单化合物的稳定性由强到弱的顺序:______(填化学式)
(5)G位于元素周期表的____区,向含有G2+离子的溶液中通入A、C形成的最简单分子至过量,观察到的现象是_________________________________________________。
-
X、Y、Z、M、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能级,各能级电子数相等,Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素原子的最外层电子数比次外层电子数少2,M原子外围电子排布式为3dn4sn;W的内层电子已全充满,最外层只有2个电子。
请回答下列问题:
(1)X元素在周期表中的位置是____;W2+离子的外围电子排布式为___。
(2)X 能与氢、氮、氧三种元素构成化合物 XO(NH2)2,其中X原子和N原子的杂化方式为分别为___、___,该化合物分子中的π键与σ键的个数之比是____;该物质易溶于水的主要原因是___。
(3)已知Be和Al元素处于周期表中对角线位置,化学性质相似,请写出Y元素与Be元素两者相应的最高价氧化物对应水化物相互反应的化学方程式:____。
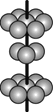
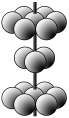
(4)M晶体的原子堆积方式为六方堆积(如图所示),则晶体中M原子的配位数是___。某M配合物的化学式是[M(H2O)5Cl]Cl2·H2O,1 mol该配合物中含配位键的数目是____。
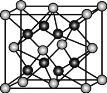
(5)Y离子和Z离子比较,半径较大的是___(填离子符号),元素Y与元素Z形成的晶体的晶胞结构是如图所示的正方体,每个Y离子周围与它最近的Y离子有___个。
-
(17分)X、Y、Z、M、W是原子序数依次增大的前四周期元素,X元素原子核外有三个能级,各能级电子数相等,Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素原子的最外层电子数比次外层电子数少2,M原子外围电子排布式为3dn4sn;W的内层电子已全充满,最外层只有2个电子。请回答:
(1)X元素在周期表中的位置是 ;
W2+离子的外围电子排布式为 。
(2)X 能与氢、氮、氧三种元素构成化合物 XO(NH2)2,其中X原子和N原子的杂化方式为分别为 、 ,该化合物分子中的 键与
键与 键的个数之比是 ;该物质易溶于水的主要原因是 。
键的个数之比是 ;该物质易溶于水的主要原因是 。
(3)已知Be和Al元素处于周期表中对角线位置,化学性质相似,请写出Y元素与Be的最高价氧化物的水化物相互反应的化学方程式
(4)M晶体的原子堆积方式为六方堆积(如图所示),则晶体中M原子配位数是 。某M配合物化学式是[M(H2O)5Cl]Cl2·H2O,1 mol该配合物中含配位键的数目是 。
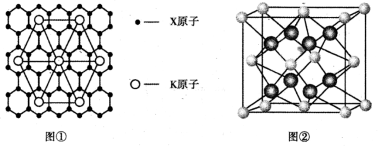
(5)X 的某种晶体为层状结构,可与熔融金属钾作用。钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图①所示,则其化学式可表示为 。
(6)Y离子和Z离子比较,半径较大的是___(写离子符号),元素Y与元素Z形成的晶体的晶胞结构是如图②所示的正方体,设晶胞中最近的两个Z离子的距离为a cm ,该化合物的摩尔质量为bg/ mol ,则该晶胞密度的计算式为 。(只要求列算式,不必计算出数值,阿伏伽德罗常数用NA表示)。
-
(10分)X、Y、Z、W、M五种元素位于周期表的前四周期,原子序数依次增大,其中X元素是宇宙中最丰富的元素,Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,W元素原子最外层电子数是内层电子数的3倍,M含有未成对电子数最多的元素。请回答下列问题。
(1)Y、Z、W的电负性由小到大的顺序为______________。(用元素符号表示)
(2)M原子的外围电子排布式为________。
(3)X2W2分子中W原子轨道的杂化类型为________。
(4)Z与W可形成的一种ZW3-阴离子,与其互为等电子体的阴离子为_______(任写一种,)。
(5)MCl3能与Z、W的氢化物形成配位数为6的配合物,且相应两种配体的物质的量之比为2∶1,氯离子全部位于外界。则该配合物的化学式为_______。
-
(16分) 已知A、B、C、D、E、F六种元素,它们的原子序数依次增大。A、E是同一主族的短周期元素,A原子最外层S能级和P能级轨道上的电子数相等,C+与B2-具有相同的电子层结构,D原子的最外层电子数等于其电子层数,且A、B、C、D、E五种元素的原子序数之和是F元素原子序数的2倍。请回答下列问题:
(1)元素E基态原子的电子排布式_____________.
(2)B、C、D三种元素形成简单离子的半径由大到小的顺序是 (用离子符号表示)
(3)F元素在元素周期表中的位置______________________.
(4)B、E两种元素形成的晶体类型为______________________.
(5)电负性:A B,
氢化物的稳定性:B E,
第一电离能:C D,
最高价氧化物对应水化物的碱性:C D(填“>”或“<”)。
-
X、Y、Z、W、M五种元素位于周期表的前四周期,原子序数依次增大,其中X元素是宇宙中最丰富的元素,Y元素原子核外有三种不同的能级且各个能级所填充的电子数相同,W元素原子最外层电子数是内层电子数的3倍,M含有未成对电子数最多的元素。请回答下列问题。
(1)Y、Z、W的第一电离能由大到小的顺序为______________。(用元素符号表示)
(2)M原子的外围电子排布式为________。
(3) X2W2分子中W原子轨道的杂化类型为________。
(4)Z与W可形成的一种ZW3-阴离子,与其互为等电子体的阴离子为_______(任写一种)。
(5)MCl3能与Z、W的氢化物形成配位数为6的配合物,且相应两种配体的物质的量之比为2∶1,氯离子全部位于外界。则该配合物的化学式为_______。
 .
.


