-
运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01mol.L-1)溶液的pH和原子序数的关系如图所示。
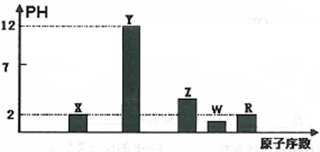
(1)元素R在周期表中的位置是______________;元素Z的原子结构示意图是__________。
(2)元素Y和W形成的Y2W2型化合物中含有化学键的类型为_____________。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等。
(1)下列能说明碳、硫两种元素非金属性相对强弱的是____________(填序号)
A. S与H2发生化合反应比C与H2化合更容易
B.酸性:H2SO3 >H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
(2)铅(Pb)、锡(Sn)、锗(Ge)与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
①锗的原子序数为__________________。
②它们+4价氢氧化物的碱性由强到弱顺序为_________________(填化学式)。
(3)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似。用电子式表示羰基硫(COS)的形成过程:________________________。
-
运用元素周期律研究元素及其化合物的性质具有重要的意义。
I.部分短周期主族元素的最高价氧化物对应水化物(浓度均为0.01mol·L-1)溶液的pH和原子序数的关系如图所示。

(1)元素R在周期表中的位置是_______;元素Z的原子结构示意图是________。
(2)元素Y和W形成的Y2W2型化合物中含有化学键的类型为________。
II.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等。
(1)下列能说明碳、硫两种元素非金属性相对强弱的是__________(填序号)
A. S与H2发生化合反应比C与H2化合更容易
B. 酸性:H2SO3 >H2CO3
C. CS2中碳元素为+4价,硫元素为-2价
(2)铅(Pb)、锡(Sn)、锗(Ge)与元素C同主族。常温下其单质在空气中,锡、锗不反应,而铅表面会生成一层氧化铅;锗与盐酸不反应,而锡与盐酸反应。由此可得出以下结论:
①锗的原子序数为_________。
②它们+4价氢氧化物的碱性由强到弱顺序为____________(填化学式)。
(3)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似。羰基硫(COS)的电子式为:______________________。
-
运用元素周期律研究元素及其化合物的性质具有重要的意义.
I.部分短周期主族元素的最高价氧化物对应的水化物(浓度均为0.01mol.L-1)溶液的PH和原子序数的关系如图所示.
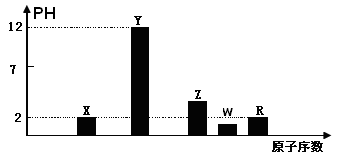
(1)元素R在周期表中的位置是
(2)元素Y和W形成的Y2W2型化合物中含有化学键的类型为
(3)请写出X的最高价氧化物对应的水化物与其气态氢化物的离子反应方程式
Ⅱ.短周期元素C、O、S能形成多种化合物,如CO2、CS2、COS等
(1)下列能说明碳、硫两种元素非金属性相对强弱的是 (填序号)
A.S与H2发生化合反应比C与H2化合更容易
B.酸性:H2SO3>H2CO3
C.稳定性:CH4<H2S
(2)羰基硫(COS)可作为一种熏蒸剂,能防止某些昆虫、线虫的危害,其分子结构和CO2相似
①羰基硫(COS)的电子式为:
②羰基硫(COS)用氢氧化钠溶液处理及利用的过程如下:
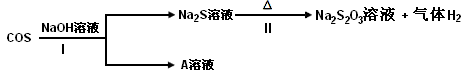
已知A是一种正盐,则反应I的化学反应方程式为
-
研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 。
(2)25℃,在0.10mol·L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
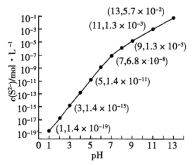
①pH=13时,溶液中的c(H2S)+c(HS-)= mol·L-1。
②某溶液含0.020 mol·L-1Mn2+、0.10 mol·L-1H2S,当溶液pH= 时,Mn2+开始沉淀。[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如下表。

①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 。
-
Ⅰ研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 。
(2)25℃,两种酸的电离平衡常数如下表:
| Ka1 | Ka2 |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K= 。
②0.10 mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为 。
③H2SO3溶液和NaHCO3溶液反应的离子方程式为 。
Ⅱ常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
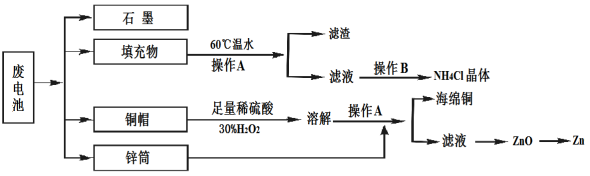
(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。
铜帽溶解完全后,可采用_________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池电解质为KOH,总反应Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该应的化学方程式: 。
-
研究硫元素及其化合物的性质具有重要意义。
(1)①硫离子的结构示意图为 ______________________。
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为______________________________________________。
(2)25 0C,在0.1mol/L H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2—)关系如图(忽略溶液体积的变化、H2S的挥发)。

①pH = 13时,溶液中的c(H2S) + c(HS—) = _____mol/L 。
②某溶液含0.02mol/LMn2+、0.10mol/LH2S,当溶液pH= ______ 时,Mn2+开始沉淀。[已知: ]
]
(3)25 0C,两种酸的电离平衡常数如表。
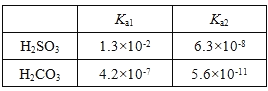
①HSO3—的电离平衡常数表达式K = ________________________。
②0.1mol/LNa2SO3溶液中离子浓度由大到小的顺序为________________。
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为____________________________。
-
X、Y、Z、W均为常见的短周期主族元素,常温下,其最高价氧化物对应的水化物溶液(浓度均为 0.01mol/L)的pH和原子半径的关系如下图所示。其中,Y为碳元素。下列有关说法正确的是
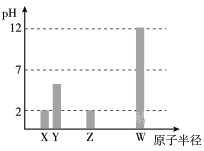
A.X是硫元素
B.Y的最高价氧化物的电子式为 
C.W的最高价氧化物对应的水化物中仅含离子键
D.Z的最高价氧化物对应水化物的化学式为HClO4
-
有一位同学,在学完周期表的知识后,大胆预测了第120号元素可能具有的性质,但其预测结果不正确的是( )
A.该元素位于周期表中第八周期,第IIA族
B.该元素最高价氧化物对应水化物具有强碱性
C.该元素在自然界中并不存在,属人造元素,且具有放射性
D.与同族已发现的其它元素相比,该元素原子半径大密度大,熔沸点高
-
元素周期表是学习化学的重要工具,下图所示为元素周期表中的一部分。表中所列的字母分别代表对应的化学元素。

(1)上述元素中,金属性最强的元素在周期表中的位置是______;最高价氧化物对应水化物中酸性最强的元素是___________(填元素符号)。常温下,其单质在浓硝酸中会发生钝化的元素是_______(填元素符号)。
(2)元素g的简单离子结构示意图为______,元素d的一种氢化物中两种原子的个数比为1: 1,则该物质的电子式为___________
(3)k元素可能的性质或应用有________。
A.是一种活泼的金属元素 B.其简单氢化物的热稳定性比h强
C.其单质可作为半导体材料 D.最高正化合价为+4
(4)下列说法正确的是________
A.简单离子半径的大小顺序: r(d>r(e>r(g)>r(f)
B.元素非金属性由强到弱的顺序:e>d>c
C.f、g、i最高价氧化物对应的水化物两两之间能发生反应
D.化合物f2d2中,阴、阳离子个数之比为1:1
(5)元素a与元素g有相似的化学性质。请写出元素a的氢氧化物与NaOH溶液反应的化学方程式:_____________。
-
下表为元素周期表的一部分,列出10种元素在周期表中的位置。用化学符号回答下列问题:
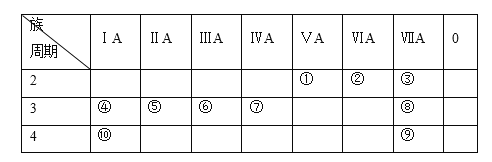
(1)10种元素中,化学性质最活泼的金属是________。
(2)④、⑤、⑥两种元素最高价氧化物对应的水化物中,碱性最强的是________。
(3)③、④两种元素形成的离子,离子半径由大到小的顺序是________。
(4)④和⑨两种元素形成化合物的化学式为________,该化合物燃烧时的焰色为________,该化合物溶液与元素⑧的单质反应的离子方程式为________。











