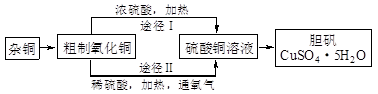-
硫酸铜晶体俗称“胆矾”,在无机化工及生产生活中有广泛的应用。某课外研究小组的同学用粗铜粉(含有碳等杂质)设计了两种制备胆矾的途径,并测定了其中结晶水的含量。设计的流程如下:
(1)“较纯铜”转化为氧化铜时,应将其置于________内进行灼烧(填写仪器名称)。“粗铜”表面的油脂可以用热碱溶液洗去,原因是________。若灼烧“粗铜”,获得的产物是混有少量铜的氧化铜。存在少量铜的可能原因是________。
a.灼烧过程中部分氧化铜被还原 b.该条件下铜无法被氧气氧化
c.氧化铜在加热过程中分解生成铜 d.灼烧不充分铜未被完全氧化
(2)通过途径I实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤是:酸溶、加热通氧气、过滤、________、冷却结晶、________、自然干燥。比较由粗制氧化铜制取胆矾的两种途径,途径Ⅰ有明显的两个优点:
① ________ ________。
②________。
(3)测定胆矾晶体里结晶水的含量时,若测定的相对误差大于零,则产生误差的原因可能是___________。
a.加热后容器未放入干燥器中冷却
b.最后两次加热后的质量相差较大
c.加热前称量时容器未完全干燥
d.加热过程中有少量溅失
(4)利用下图装置加热无水硫酸铜粉末直至完全分解,A的试管中剩余黑色粉末,用带火星的木条伸入集气瓶D,发现木条能复燃。反应前后各装置的质量见图下方的表格所示。
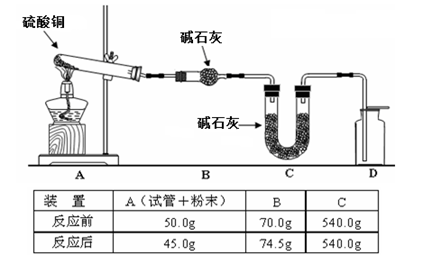
请通过计算,推断该实验条件下硫酸铜分解的化学方程式:________。
-
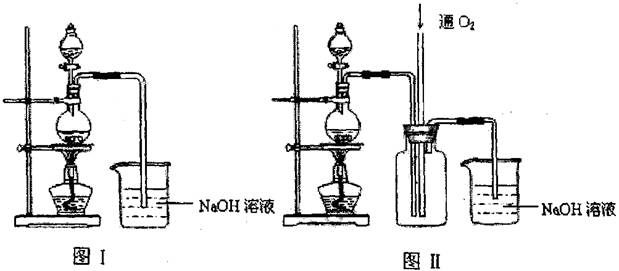
(12分)硫酸铜是一种应用极其广泛的化工原料.某课外兴趣小组将适量浓硝酸分多次加到铜粉与稀硫酸的混合物中,加热使之反应完全(装置如图I、图Ⅱ所示),通过蒸发、结晶得到硫酸铜晶体,并同时测定硫酸铜晶体中结晶水的含量.
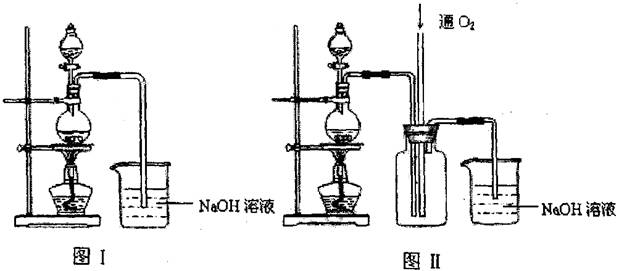
(1)怎样检查图I装置的气密性 ________。
(2)图I中分液漏斗内装的液体是________。
(3)图Ⅱ是图Ⅰ的改进装置,与图I相比,图Ⅱ装置的明显优点是________,
________,________,(可不答满).
(4)课外兴趣小组同学在测定胆矾(CuSO4·χH2O)晶体中结晶水的含量时.测得有关数据如下表:
| 加热前质量 | 加热后质量 |
| m1(容器) | m2(容器+晶体) | m3(容器+无水CuSO4) |
| 5.4g | 7.9g | 6.8g |
①为完成测定,图Ⅲ中还缺少的仪器名称是。

②判断样品已恒重的方法是________。
③测定所得胆矾(CuSO4·χH2O)中结晶水含量的实验中,称量操作至少进行________次。
④课外兴趣小组的测定结果x值(与CuSO4·5H2O相比)________(填“偏高”、“偏低”、“不变”),可能的原因是________。(填字母序号)
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
-
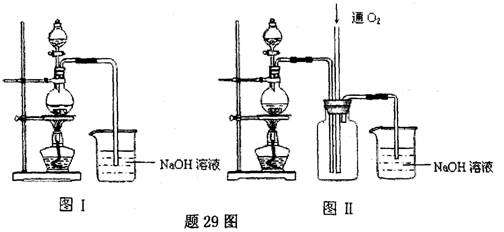
硫酸铜是一种应用极其广泛的化工原料.某课外兴趣小组将适量浓硝酸分多次加到铜粉与稀硫酸的混合物中,加热使之反应完全(装置如图I、图Ⅱ所示),通过蒸发、结晶得到硫酸铜晶体,并同时测定硫酸铜晶体中结晶水的含量.
(1)怎样检查图I装置的气密性 ________。
(2)图I中分液漏斗内装的液体是________。
(3)图Ⅱ是图Ⅰ的改进装置,与图I相比,图Ⅱ装置的明显优点是 ,
________,________,(可不答满).
(4)课外兴趣小组同学在测定胆矾(CuSO4·χH2O)晶体中结晶水的含量时.测得有关数据如下表:
| 加热前质量 | 加热后质量 |
| m1(容器) | m2(容器+晶体) | m3(容器+无水CuSO4) |
| 5.4g | 7.9g | 6.8g |
①为完成测定,图Ⅲ中还缺少的仪器名称是________。
②判断样品已恒重的方法是________。
③测定所得胆矾(CuSO4·χH2O)中结晶水含量的实验中,称量操作至少进行________次。
④课外兴趣小组的测定结果x值(与CuSO4·5H2O相比)________(填“偏高”、“偏低”、“不变”),可能的原因是________。(填字母序号)
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
| ________学校 姓名________ 考号________ 班级________ |
| ……………………………………………密………………………………………封……………………………………………….线…………………………………………………. |
-
(18分)
硫酸铜是一种应用极其广泛的化工原料.某课外兴趣小组将适量浓硝酸分多次加到铜粉与稀 硫酸的混合物中,加热使之反应完全(装置如题29图I、图Ⅱ所示),通过蒸发、结晶得到硫酸铜晶体,并同时测定硫酸铜晶体中结晶水的含量.
(1)怎样检查图I装置的气密性 ________。
(2)图I中分液漏斗内装的液体是。
(3)图Ⅱ是图Ⅰ的改进装置,与图I相比,图Ⅱ装置的明显优点是________,
________,________,(可不答满).
(4)课外兴趣小组同学在测定胆矾 晶体中结晶水的含量时.测得有关数据如下表:
晶体中结晶水的含量时.测得有关数据如下表:
| 加热前质量 | 加热后质量 |
| m1(容器) | m2(容器+晶体) | m3(容器+无水CuSO4) |
| 5.4g | 7.9g | 6.8g |
①为完成测定,题29图Ⅲ中还缺少的仪器名称是________。
②判断样品已恒重的方法是________。
③测定所得胆矾 中结晶水含量的实验中,称量操作至少进行________次。
中结晶水含量的实验中,称量操作至少进行________次。
④课外兴趣小组的测定结果x值(与 相比)________(填“偏高”、“偏低”、“不变”),可能的原因是________。(填字母序号)
相比)________(填“偏高”、“偏低”、“不变”),可能的原因是________。(填字母序号)
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
-
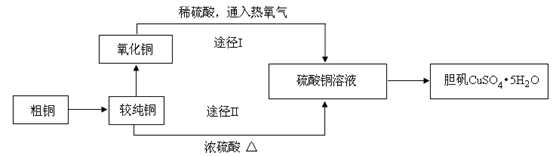
某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
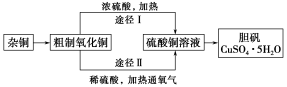
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于 上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:
a.蒸发皿
b.石棉网
c.泥三角
d.表面皿
e.坩埚钳
f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是 。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是 、 。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行 次。
(6)若测定结果x值偏高,可能的原因是 (填字母编号)。
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
-
某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
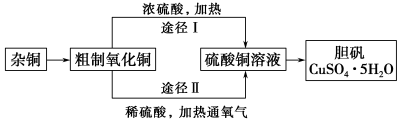
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于 上(用以下所给仪器的编号填入,下同),取用坩埚应使用 ,灼烧后的坩埚应放在 上,不能直接放在桌面上。
实验所用仪器:
a蒸发皿;b石棉网;c泥三角;d表面皿;e坩埚钳;f试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,灼烧后含有少量铜的可能原因是 。
a.灼烧过程中部分氧化铜被还原
b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜
d.该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、 、冷却结晶、 、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优点是 、 。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行 次。
(6)若测定结果x值偏高,可能的原因是 (填字母编号)。
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.胆矾晶体部分风化
-
(实验化学)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾.其设计的实验过程为:
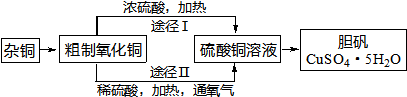
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于______上(用以下所给仪器的编号填入,下同),取用坩埚应使用______,灼烧后的坩埚应放在______上,不能直接放在桌面上.
实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾.灼烧后含有少量铜的可能原因是______
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化
(3)通过途径 II实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、______、冷却结晶、______、自然干燥.
(4)由粗制氧化铜通过两种途径制取胆矾,与途径 I相比,途径 II有明显的两个优点是:______、______.
(5)在测定所得胆矾中结晶水x值的实验中:称量操作至少进行______次.
(6)若测定结果x值偏高,可能的原因是______
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化.
-
(10分)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
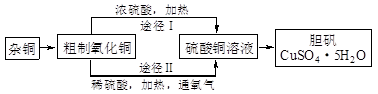
(1)杂铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于________上(用以下所给仪器的编号填入,下同),取用坩埚应使用________,灼烧后的坩埚应放在________上冷却,不能直接放在桌面上。
所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是________。
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化
(3)通过途径II实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、_____、冷却结晶、________、自然干燥。
(4)由粗制氧化铜通过两种途径制取胆矾,与途径I相比,途径II有明显的两个优点是:
________、________。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验中,若测定结果x值偏高,可能的原因是________。
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化
-
某课外研究小组,用含有较多杂质的铜粉,通过不同的化学的反应制取胆矾.其设计的实验过程为:
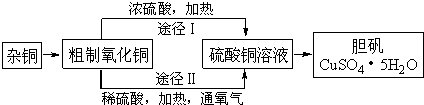
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于______上(用以下所给仪器的编号填入,下同),取用坩埚应使______,灼烧后的坩埚应放在______上,不能直接放在桌面上.
实验所用仪器:a.蒸发皿 b.石棉网 c.泥三角 d.表面皿 e.坩埚钳 f.试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾.灼烧后含有少量铜的可能原因是______.
a.灼烧过程中部分氧化铜被还原 b.灼烧不充分铜未被完全氧化
c.氧化铜在加热过程中分解生成铜 d.该条件下铜无法被氧气氧化
(3)通过途径II实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、______、冷却结晶、______、自然干燥.
(4)由粗制氧化铜通过两种斜径制取胆矾,与途径I相比,途径II有明显的两个优点是:______、______.
(5)在测定所得胆矾中结晶水x值的实验过程中,若测定结果x 值偏高,可能的原因是______.
a.加热温度过高 b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却 d.胆矾晶体部分风化.
-
(9分)某课外研究小组,用含有较多杂质的铜粉,通过不同的化学反应制取胆矾。其设计的实验过程为:
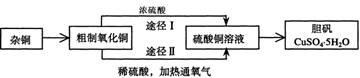
(1)铜中含有大量的有机物,可采用灼烧的方法除去有机物,灼烧时将瓷坩埚置于
________上(用以下所给仪器的编号填入,下同),取用坩埚应使用________,灼烧后的坩埚应放在________上,不能直接放在桌面上。实验所用仪器:a 蒸发皿 b 石棉网 c 泥三角
d 表面皿 e 坩埚钳 f 试管夹
(2)杂铜经灼烧后得到的产物是氧化铜及少量铜的混合物,用以制取胆矾。灼烧后含有少量铜的可能原因是________
a 灼烧过程中部分氧化铜被还原 b 灼烧不充分铜未被完全氧化
c 氧化铜在加热过程中分解生成铜 d 该条件下铜无法被氧气氧化
(3)通过途径Ⅱ实现用粗制氧化铜制取胆矾,必须进行的实验操作步骤:酸溶、加热通氧气、过滤、________、冷却结晶、________、自然干燥
(4)由粗制氧化铜通过两种途径制取胆矾,与途径Ⅰ相比,途径Ⅱ有明显的两个优是:________、________