-
(12)氨是重要的无机化工原料,也是合成氮肥的主要原料,因此合成氨在国民经济中占有重要地位。
⑴工业合成氨反应的化学方程式为________。
⑵恒温下,向一个2L的密闭容器中充入1mol N2和2.6mol H2,20min时,反应达到平衡,容器内c(NH3)为0.08 ,则c(H2)=________,20min内,用N2浓度的变化表示的反应速率为________。
,则c(H2)=________,20min内,用N2浓度的变化表示的反应速率为________。
⑶某温度下,向一个2L的密闭容器中充入1mol N2和3mol H2,在恒温下反应,以下能说明反应达到平衡状态的是________
①单位时间内消耗0.1molN2的同时生成0.2molNH3
②单位时间内生成0.3molH2的同时生成0.2molNH3
③n(N2)∶n(H2)∶n(NH3)=1∶3∶2
④c(NH3)=0.08mol/L
⑤容器内压强不变
⑷工业上约有80%的氨用于制造化肥。某化肥厂生产铵态氮肥(NH4)2SO4的反应可表示为:CaSO4+2NH3+CO2+H2O= CaCO3+(NH4)2SO4
①反应前先将CaSO4磨成粉末,加入水中制成悬浊液,则所得分散系中分散质粒子直径 10-7m(填“>”或“<”)。
②向CaSO4悬浊液中通入气体时,需先通入足量NH3再通入CO2,原因是。
-
氨对地球上的生物相当重要,它是许多食物和肥料的重要成分。氨也是制造硝酸、化肥、炸药 的重要原料。氨在国民经济中占有重要地位。回答下列问题:
(1)合成氨工业中,合成塔中每产生2 mol NH3,放出92.2 kJ热量。
①工业合成氨的热化学方程式是_______________。
②若起始时向容器内放入1 mol N2和3 mol H2,达平衡后N2的转化率为20%,则反应放出的热量为Q1 kJ,则Q1的数值为____________;若在同体积的容器中充人2 mol N2和6 molH2,达平衡后放出的热量为Q2 kJ,则Q2__________(填“>”、“<”或“=”)2Q1。
③已知:

1 mol N-H键断裂吸收的能量约等于__________kJ。
(2)在0.5L的密闭容器中,一定量的氮气和氢气进行合成氨反应:N2 (g)+3H2 (g) 2NH3 (g),其平衡常数K与温度T的关系如下表:
2NH3 (g),其平衡常数K与温度T的关系如下表:
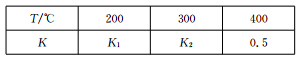
①平衡常数表达式K=_________,K1___________(填“>”、“<”或“一”)K2。
②一定温度下,下列各项能作为判断该反应达到化学平衡状态的依据是__________(填字母)。
a.容器内N2、H2、NH3的浓度之比为1: 3:2
b.浓度商Q=平衡常数K
c.容器内压强保持不变
d.混合气体的密度保持不变
③在400℃时,当测得N2、H2和NH3的物质的量分别为2 mol、1 mol、2 mol时,则此时该反应_________(填“处于”或“不处于”)平衡状态。
-
(8分)氨在国民经济中占有重要地位。
(1)已知合成氨反应:N2(g)+3H2(g)  2NH3(g) ΔH < 0;在某密闭容器中充入合成氨的原料气(N2、H2),一定时间后达到平衡。为提高氨合成反应速率,同时使平衡向氨合成方向移动。下列措施可行的是 (填写编号)
2NH3(g) ΔH < 0;在某密闭容器中充入合成氨的原料气(N2、H2),一定时间后达到平衡。为提高氨合成反应速率,同时使平衡向氨合成方向移动。下列措施可行的是 (填写编号)
① 升高温度; ② 缩小容器体积(加压); ③ 选择高效催化剂; ④ 在恒容条件下,再充入合成氨的原料气(N2、H2); ⑤在恒容条件下,再充入原平衡的混合气;⑥在恒容条件下,分离出氨气。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
| T / ℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
ΔH(填“>”、“<”或“=”) 0。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比) ,下图是氨碳比(x)与CO2平衡转化率(α%)的关系。α随着x增大而增大的原因是 。
,下图是氨碳比(x)与CO2平衡转化率(α%)的关系。α随着x增大而增大的原因是 。

③上图中的B点处,NH3的平衡转化率为 。
-
氮及其化合物的转化是资源利用和环境保护的重要研究课题。
(1)合成氨工业是最基本的无机化工之一,氨是化肥工业和基本有机化工的主要原料。 合成氨反应中有关化学键键能数据如下表:
| 化学键 | H—H | N≡N | N—H |
| E/ kJ•mol﹣1 | 436 | 946 | 391 |
①已知:合成氨反应:N2(g)+3H2(g) 2NH3(g)的活化能Ea=508 kJ•mol﹣1,则氨分解反应:2NH3(g)
2NH3(g)的活化能Ea=508 kJ•mol﹣1,则氨分解反应:2NH3(g) N2(g)+3H2(g)的活化能Ea=_____。
N2(g)+3H2(g)的活化能Ea=_____。
②下图表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:_____(保留3位有效数字)。
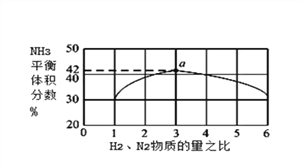
③依据温度对合成氨反应的影响,在图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,N2物质的量变化的曲线示意图_______________。
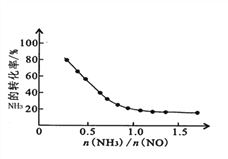
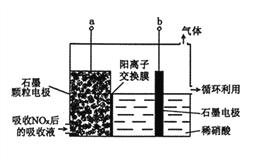
(2)选择性催化还原脱硝技术(SCr)是目前较成熟的烟气脱硝技术,该技术是指在温度300~420℃之间和催化剂条件下,用还原剂(如NH3)选择性地与NOx反应。
①SCr脱硝技术中发生的主要反应为:4NH3(g)+4NO(g)+O2(g) 4N2(g)+6H2O(g)△H=-1625.5kJ·mol-1;氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当n(NH3)/n(NO)>1.0时,烟气中NO浓度反而增大,主要原因是_____。
4N2(g)+6H2O(g)△H=-1625.5kJ·mol-1;氨氮比[n(NH3)/n(NO)]会直接影响该方法的脱硝率。350℃时,只改变氨气的投放量,氨气的转化率与氨氮比的关系如图所示。当n(NH3)/n(NO)>1.0时,烟气中NO浓度反而增大,主要原因是_____。
②碱性溶液处理烟气中的氮氧化物也是一种脱硝的方法,写出NO2被Na2CO3溶液吸收生成三种盐的化学反应方程式_____。
③直接电解吸收也被用于脱硝。用6%的稀硝酸吸收NOx生成亚硝酸,再将吸收液导入电解槽电解,使之转化为硝酸。电解装置如图所示。阳极的电极反应式为_____。
-
(12分)已知两个醛分子在一定条件下可发生如下反应:
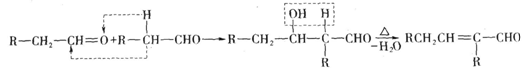
A是石油化学工业最重要的基础原料,以A为有机原料,无机试剂任选,按下列途径合成一种常见的医用胶,结构简式为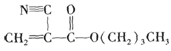 (副产物均未写出)。
(副产物均未写出)。
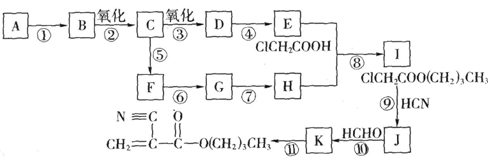
请回答下列问题:
(1)B的结构简式是________;J的结构简式是________。
(2)上述反应中,属于取代反应的有________(填反应序号,下同);属于消去反应的有________。
(3)写出下列反应的化学方程式
反应⑤________
反应⑧
-
氨气是重要化工原料,在国民经济中占重要地位。工业合成氨的反应为:N2(g)+3H2(g) ⇌2NH3(g) △H<0
(1)图表示合成NH3反应在某段时间t0→t6中反应速率与反应过程 曲线图,t1、t3、t4 时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是___________(填写下列序号)
曲线图,t1、t3、t4 时刻分别改变某一外界条件,则在下列到达化学平衡的时间段中,NH3的体积分数最小的一段时间是___________(填写下列序号)
A.t0→t1 B.t2→t3 C.t3→t4 D.t5→t6
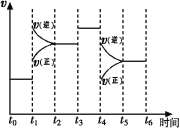
t4时改变的条件是________________。
现进行如下研究:在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如表:
| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| n(NH3)/mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(2)反应在0—10分钟内以氮气浓度变化表示的反应速率为___________,该温度下,此反应的平衡常数K=____________。
(3)该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3mo/L、3mol/L、3mo/L,则此时V正_____V逆 (填“>”“<”或“=”)。
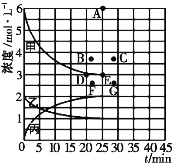
(4)由上表中的实验数据计算得到“浓度一时间”的关系可用右图中的曲线表示,表示c(N2)-t的曲线是______(填“甲”“乙”或“丙”)。在此温度下,若起始充入4molN2和12 molH2,则反应刚达到平衡时,表示c(H2)-t的曲线上相应的点为_________。
-
氨气是重要化工原料,在国民经济中占重要地位。工业合成氨的反应为:N2(g)+3H2(g) 2NH3(g) △H<0进行如下研究:在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3) 与反应时间t的关系如下表:
2NH3(g) △H<0进行如下研究:在773K时,分别将2molN2和6molH2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3) 与反应时间t的关系如下表:
| t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| n(H2) /mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
| n(NH3) /mol | 0 | 1.00 | 1.60 | 1.80 | 1.98 | 2.00 | 2.00 |
(1)反应速率最快的时间段是__________
A.0min-5min B .5min-10min C.10min-15min D. 15min-20min
(2)该温度下,若向同容积的另一容器中投入的N2、H2、NH3的浓度分别为3mol/L、3mol/L、3mol/L,则此时v正 __________v逆 (填 “>”“<”或“=”)。
(3)NH3合成常见的化肥尿素【化学式为CO(NH2)2】分为三步,其中第一步为:2NH3(g)+CO2(g) NH2COONH4(s) △H=-160kJ/mol, 对于这个反应,在2L等容密闭容器中充入2molNH3和1molCO2,平衡时放出128kJ的热量,NH3 的转化率为__________若反应温度不变,在该容器中充入2.8molNH3和1.4molCO2,到达平衡时。c(NH3)为__________。
NH2COONH4(s) △H=-160kJ/mol, 对于这个反应,在2L等容密闭容器中充入2molNH3和1molCO2,平衡时放出128kJ的热量,NH3 的转化率为__________若反应温度不变,在该容器中充入2.8molNH3和1.4molCO2,到达平衡时。c(NH3)为__________。
(4)以氨气代替氢气研发氨燃料电池是当前科研的一个热点。
①氨燃料电池使用的电解质溶液是4mol·L-1的KOH溶液,电池反应为: 4NH3+3O2=2N2+6H2O。该反应每消耗3.4g NH3转移的电子数目为__________;
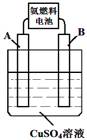
②氨燃料电池电解CuSO4溶液,如图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,然后向所得溶液中加入19.6gCu(OH)2固体后恰好可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为__________L。
-
(一)氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱的原料,也是一种常用的制冷剂。
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L 的密闭容器内充入1mol N2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间 /min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25 min 时,以N2 表示的平均反应速率=__________。
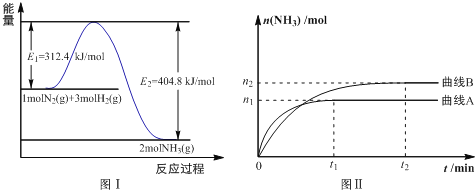
(2)工业合成氨的反应方程式为:N2(g)+3H2(g) 2NH3(g) ΔH,下图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) ΔH,下图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图2是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
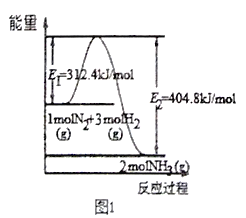

下列说法正确的是________________。
A.ΔH=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的浓度越低越好
D.图II是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB;
E.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为 mol·L-1·min-1
mol·L-1·min-1
(3)一定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时测得容器的压强为起始时的 倍,在同一温度,同一容器中,将起始物质改为amol N2 ,b molH2,c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
倍,在同一温度,同一容器中,将起始物质改为amol N2 ,b molH2,c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
(二)在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________mol·L-1·s-1
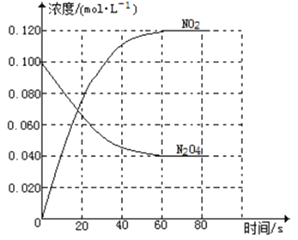
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。T_______100℃(填“大于”“小于”),判断理由是________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______(填“正反应”或“逆反应”)方向移动,判断理由是__________________。
(4)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+2H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应CH3CH2OH(g)=CH3OCH3(g)) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H=____________ kJ·mol-1。
-
(一)氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱的原料,也是一种常用的制冷剂。
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L 的密闭容器内充入1mol N2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间 /min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25 min 时,以N2 表示的平均反应速率=__________。
(2)工业合成氨的反应方程式为: N2(g)+3H2(g) 2NH3(g) ΔH 下图Ⅰ是合成氨反应的能量与反应过程相关图(未使用催化剂);图Ⅱ是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) ΔH 下图Ⅰ是合成氨反应的能量与反应过程相关图(未使用催化剂);图Ⅱ是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
下列说法正确的是________________。
A.ΔH=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的浓度越低越好
D.图Ⅱ是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB;
E.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为 mol·L-1·min-1
mol·L-1·min-1
(3)一定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时测得容器的压强为起始时的7/9倍,在同一温度,同一容器中,将起始物质改为amol N2 ,b molH2,c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
(二) 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) 2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
2NO2(g),随温度升高,混合气体的颜色变深。回答下列问题:
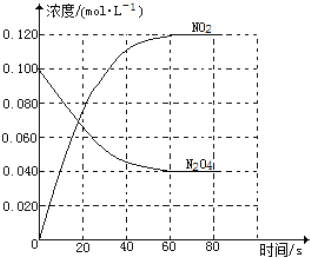
(1)反应的△H______0(填“大于”“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为________mol·L-1·s-1
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。T_______100℃(填“大于”“小于”),判断理由是________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向_______(填“正反应”或“逆反应”)方向移动,判断理由是__________________。
(4)已知:
甲醇脱水反应2CH3OH(g)=CH3OCH3(g)+H2O(g) △H1=-23.9kJ·mol-1
甲醇制烯烃反应2CH3OH(g)=C2H4 (g)+H2O(g) △H2=-29.1kJ·mol-1
乙醇异构化反应2CH3OH(g)=CH3OCH3(g)) △H3=+50.7kJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H=____________ kJ·mol-1。
-
氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱的原料,也是一种常用的制冷剂。
(1)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L 的密闭容器内充入1mol N2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间 /min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25 min 时,以N2 表示的平均反应速率=__________;该温度下 平衡常数K=___________。
(2)工业合成氨的反应方程式为: N2(g)+3H2(g) 2NH3(g) ΔH 下图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图D 是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) ΔH 下图1是合成氨反应的能量与反应过程相关图(未使用催化剂);图D 是合成氨反应在2L 容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
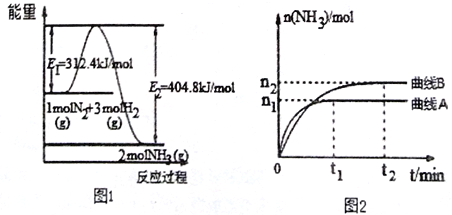
下列说法正确的是________________。
A.ΔH=-92.4kJ/mol
B.使用催化剂会使E1的数值增大
C.为了提高转化率,工业生产中反应的浓度越低越好
D.图II是不同压强下反应体系中氨的物质的量与反应时间关系图,且PAB
E.图II是不同温度下反应体系中氨的物质的量与反应时间关系图,且TA>TB;
F.该反应的平銜常数KAB
G.在曲线A条件下,反应从开始到平衡,消耗N2的平均速率为 mol·L-1·min-1
mol·L-1·min-1
(3)一定温度下,向一个容积为2 L的密闭容器中通入2 mol N2和7 mol H2,达到平衡时测得容器的压强为起始时的 倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 ,b molH2,c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 ,b molH2,c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
,则c(H2)=________,20min内,用N2浓度的变化表示的反应速率为________。







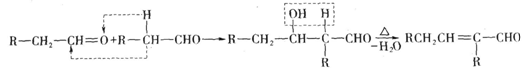
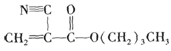 (副产物均未写出)。
(副产物均未写出)。








