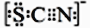-
(16分)某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
(1)①装置A中发生反应的离子方程式是 。
②整套实验装置存在一处明显的不足,请指出 。
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.Fe3+ +3SCN- Fe(SCN)3 是一个可逆反应。 Fe(SCN)3 是一个可逆反应。 ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。 ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。 ⅳ.AgClO、AgBrO均可溶于水。 |
①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因 ,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加 溶液,若溶液颜色 ,则上述解释是合理的。
②探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因 、
-
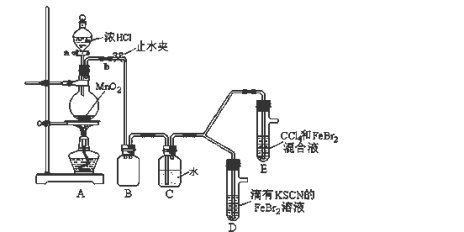
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
(1)①装置A中发生反应的离子方程式是_____________________。
②整套实验装置存在一处明显的不足,请指出_______________________。
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ________________________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN- Fe(SCN)3 是一个可逆反应。
Fe(SCN)3 是一个可逆反应。
ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。
ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。
ⅳ.AgClO、AgBrO均可溶于水。
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因___________________________________________,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加______________溶液,若溶液颜色________,则上述解释是合理的。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释产生白色沉淀原因__________________、_______________________
-
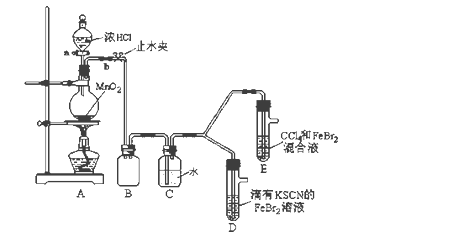
为探究Cl2、Br2、Fe3+的氧化性强弱,某化学兴趣小组设计了如下实验:
(1)①A是氯气发生装置,其反应的离子方程式是__________________________________。
②B装置的作用是_________________________,C装置的作用是_______________________,整套实验装置存在一处明显不足,请指出_______________________________________________________。
(2)用改正后的装置进行实验。实验过程如下:
| 实验操作 | 实验现象 |
| 打开活塞a,向圆底烧瓶中滴入少量浓盐酸,然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中: 振荡后水层溶液变黄,CCl4无明显变化 |
继续滴入浓盐酸,D、E中均发生了新的变化:
D装置中:红色慢慢褪去。E装置中:CC14层先由无色变为橙色,后颜色逐渐变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
I:(SCN)2 性质与卤素相似,氧化性Cl2大于(SCN)2,且SCN-的电子式为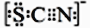
II:AgClO、AgBrO 均可溶于水
Ⅲ:Cl2 和Br2反应生成BrCl、BrCl呈红色,沸点约为5℃,与水发生水解反应
①小组同学认为D装置中红色褪去的原因是由于SCN-被Cl2氧化,但一定不是碳元素被氧化,他的理由是__________________________________________。
②经过实验证实了小组同学推测的合理性,请用平衡移动原理解释Cl2过量时D中溶液红色褪去的原因__________________________________________。
③欲探究E 中继续滴加浓盐酸后颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因_________________________________________________。
-
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
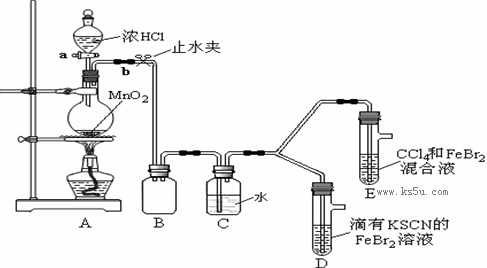
①检查气体发生装置A的气密性的操作是________。
②整套实验装置存在一处明显的不足,请指出:________。
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,CCl4层无明显变化。 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: ________ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2 。 ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点约5℃,与水发生水解反应。 ⅲ.AgClO、AgBrO均可溶于水。 |
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因:
________,
请设计简单实验证明上述解释:。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因:。
③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为。
-
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计如下实验:

(1)整套实验装置存在一处明显的不足,请指出:__________。
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,CCl4层无明显变化 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为____ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。①为探究上述实验现象的本质,小组同学查得资料如下:(SCN)2性质与卤素单质类似。氧化性:Cl2>(SCN)2。请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因________________________________;请设计简单实验证明上述解释:__________________________。
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因:_______________。
③将少量BrCl通入到碘化钾溶液中,该反应的化学方程式为_______________________________。
-
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
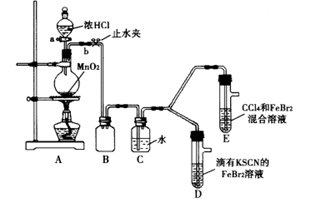
(1)①连接仪器:把玻璃导管插入橡胶塞的操作是:________,然后对准橡胶塞上得空稍稍用力转动,将其插入。
②检查气体发生装置A的气密性的操作是:________,向分液漏斗中注水,若水不能顺利流下,则气密性良好。
(2)整套实验装置存在一处明显不足,请指出________。
用改正后的装置进行实验。实验过程如下:

(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化:
D装置中:红色慢慢褪去。
E装置中:CC14层先由无色变为橙色,后颜色逐渐变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:

①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因________,请设计简单实验证明上述解释:________。
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因________。
-
(15分)已知铁离子,氯气、溴均为常见的氧化剂,某化学兴趣小组设计了如下实验探究其强弱:
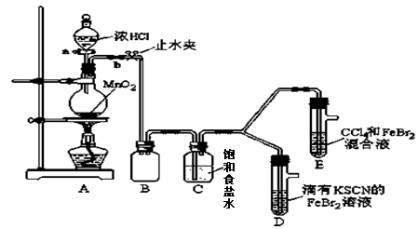
(1)①装置A中发生反应的离子方程式是 。
②整套实验装置存在一处明显的不足,请指出 。
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 | 实验现象 | 结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后 。 (填具体实验操作) | D装置中:溶液变红 E装置中:水层溶液变黄, 振荡后,下层CCl4层无明显变化。一段时间后 。(填实验现象) | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: Cl2 >Br2 >Fe3+ |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。
D装置中:红色慢慢褪去。
E装置中:CCl4层颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
| ⅰ.Fe3+ +3SCN- Fe(SCN)3 是一个可逆反应。 Fe(SCN)3 是一个可逆反应。 ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2 > (SCN)2 。 |
①请用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因 。
现设计简单实验证明上述解释:取少量褪色后的溶液,滴加 溶液,若溶液颜色 。则上述解释是合理的。
小组同学另查得资料如下:
| ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。 ⅳ.AgClO、AgBrO均可溶于水。 |
②欲探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步离子方程式解释仅产生白色沉淀原因 、 。
-
(1)某化学兴趣小组的同学进行Cl2、NH3的制备、性质等实验的流程和部分装置如下:
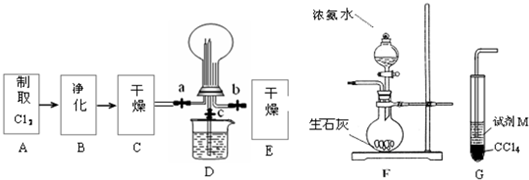
①请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断小心振荡G装置中的试管).请回答A中发生反应的离子方程式______ Cl2↑+Mn2++2H2O
-
(1)某化学兴趣小组的同学进行Cl2、NH3的制备及性质检验等实验的流程和部分装置如下:

请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断地小心振荡G装置中的试管)。A中反应物是KMnO4和浓盐酸,请写出A中发生反应的化学方程式:,请写出试剂M为________溶液,证明氧化性为Cl2>Fe3+>I2的实验现象是________ 。
②已知3Cl2+2NH3=6HCl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为黄绿色气体消失,产生白烟,反应一段时间后,关闭b打开c,观察到的现象为_________________________________________________________________。
(2)某废水中含有一定量的Na+、SO ,可能含有CO
,可能含有CO ,某研究小组欲测定其中SO
,某研究小组欲测定其中SO 的浓度,设计如下实验方案:
的浓度,设计如下实验方案:

①从下列试剂中选择试剂X为_________(填序号);
A.0.1 mol/L KMnO4(H2SO4酸化)溶液 B.0.5 mol/L NaOH溶液
C.新制氯水 D.KI溶液
②加入试剂X生成SO 的离子方程式为_____________________________________;
的离子方程式为_____________________________________;
③证明该废水中是否含有CO 的实验方案为________。
的实验方案为________。
-
(1)某化学兴趣小组的同学进行Cl2、NH3的制备及性质检验等实验的流程和部分装置如下:
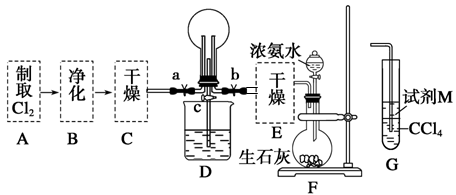
请利用A、G装置设计一个简单的实验验证Cl2、Fe3+、I2的氧化性强弱为Cl2>Fe3+>I2(实验中不断地小心振荡G装置中的试管)。A中反应物是KMnO4和浓盐酸,请写出A中发生反应的化学方程式:,请写出试剂M为________溶液,证明氧化性为Cl2>Fe3+>I2的实验现象是________ 。
②已知3Cl2+2NH3=6HCl+N2,当D的烧瓶中充满黄绿色气体后,关闭a、c打开b,D中的现象为黄绿色气体消失,产生白烟,反应一段时间后,关闭b打开c,观察到的现象为_________________________________________________________________。
(2)某废水中含有一定量的Na+、SO ,可能含有CO
,可能含有CO ,某研究小组欲测定其中SO
,某研究小组欲测定其中SO 的浓度,设计如下实验方案:
的浓度,设计如下实验方案:

①从下列试剂中选择试剂X为_________(填序号);
A.0.1 mol/L KMnO4(H2SO4酸化)溶液 B.0.5 mol/L NaOH溶液
C.新制氯水 D.KI溶液
②加入试剂X生成SO 的离子方程式为_____________________________________;
的离子方程式为_____________________________________;
③证明该废水中是否含有CO 的实验方案为________。
的实验方案为________。