-
目前工业上有一种方法是用CO2来生产燃料甲醇.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ/mol,为探究反应原理,现进行如下实验:
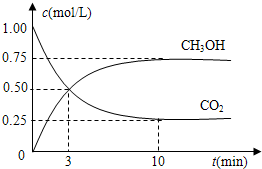
在体积为1L的密闭容器中,充入1mol CO2和4mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示.
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=______mol/.
(2)该反应的平衡常数表达式为______.
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是______.
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和4mol H2
(4)如果在相同的容器中事先充入1mol CH3OH和1mol H2O,为了使反应达到的化学平衡和上述一样,则起始还需加入H2的物质的量为______.
-
目前工业上有一种方法是用CO2来生产燃料甲醇。
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,为探究反应原理,现进行如下实验:
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,为探究反应原理,现进行如下实验:
在体积为1 L的密闭容器中,充入1mol CO2和4 mol H2,一定条件下发生反应:测得CO2和CH3OH(g)的浓度随时间变化如图所示。
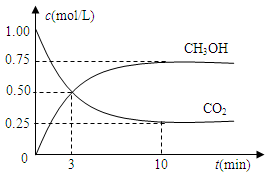
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=________mol/(L·min)。
(2)该反应的平衡常数表达式为________。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1 mol CO2和4 mol H2
(4)如果在相同的容器中事先充入1 mol CH3OH和1 mol H2O,为了使反应达到的化学平衡和上述一样,则起始还需加入H2的物质的量为________。
-
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:CO2(g) + 3H2(g) 
 CH3OH(g) +H2O(g)
CH3OH(g) +H2O(g)
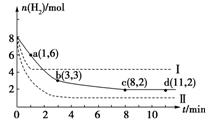
△H=-49.0 kJ·mol-1。某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如下图中实线所示(图中字母后的数字表示对应的坐标)
回答下列问题:
(1)该反应在0~8 min内CO2的平均反应速率是________mol/(L•min)。
(2)该反应的平衡常数K=________。
(3)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比曲线Ⅰ改变的条件可能是________,曲线Ⅱ改变的条件可能是。若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是
________
(4)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的________
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
-
目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=—49.0 kJ·
CH3OH(g)+H2O(g) ΔH=—49.0 kJ· mol-1。现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
mol-1。现向体积为1L的密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
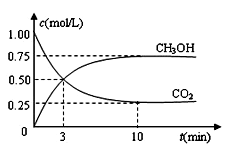
(1)从反应开始到平衡,氢气的平衡浓度为C(H2)=_____________;
(2)若改变条件使平衡向正反应方向移动,则平衡常数______________(填序号)
a.可能不变 b.可能减小 c.可能增大 d.不变、减小、增大皆有可能
(3)能够说明该反应已达到平衡的是__________(填字母序号,下同)。
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO2、H2和CH3OH的浓度保持不变
D.一定条件下,单位时间内消耗3molH2的同时生成1mol CH3OH
(4)在其他条件不变的情况下,将体系体积压缩到原来的二分之一,下列有关该体系的说法正确的是________。
a.氢气的浓度减小 b.正反应速率增大,逆反应速率也增大
c.甲醇的物质的量增加 d.重新平衡时n(H2)/n(CH3OH)增大
(5)求此温度(T)下该反应的平衡常数K= ________。若开始时向该1L密闭容器中充入1mol CO2,2mol H2,1.5mol CH3OH和1mol H2O(g),则反应向________(填“正”或“逆”)反应方向进行。
-
固定和利用CO2,能有效地利用资源,并减少空气中的温室气体。工业上正在研究利用CO2来生产甲醇燃料的方法,该方法的化学方程式是:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H= -49.0 kJ/mol
CH3OH(g)+H2O(g) △H= -49.0 kJ/mol
某科学实验将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变),测得H2的物质的量随时间变化如右图中实线所示(图中字母后的数字表示对应的坐标):
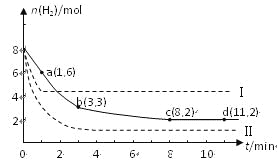
回答下列问题:
(1)该反应在_____条件下能自发进行(填编号)。
A.高温 B.低温 C.任何温度
(2)该反应在0~8 min内CO2的平均反应速率是_________mol/(L•min)。
(3)该反应的平衡常数K=_______。
(4)仅改变某一条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示。与实线相比,曲线Ⅰ改变的条件可能是__________,曲线Ⅱ改变的条件可能是_______________。
若实线对应条件下平衡常数为K,曲线Ⅰ对应条件下平衡常数为K1,曲线Ⅱ对应条件下平衡常数为K2,则K、K1和K2的大小关系是______________。
(5)根据化学反应速率与化学平衡理论,联系化工生产实际,你认为下列说法不正确的是
________。
A.化学反应速率理论可指导怎样在一定时间内快出产品
B.有效碰撞理论可指导怎样提高原料的转化率
C.勒夏特列原理可指导怎样使用有限原料多出产品
D.催化剂的使用是提高产率的有效方法
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益
-
(14分)固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
某科学实验将6molCO2和8molH2充入体积为2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。

(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是__________,最小的是__________。
A.0~1min B.1~3min C.3~8min D.8~11min
(3)如果体积可变,仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是__________________,曲线II(更快平衡)对应的实验条件改变是___________ 。
(4)求平衡时氢气的转化率和该条件下反应的平衡常数K。(写出计算过程)
-
(7分) 固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H = -49.0 kJ·mol-1。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
CH3OH(g)+H2O(g) △H = -49.0 kJ·mol-1。某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
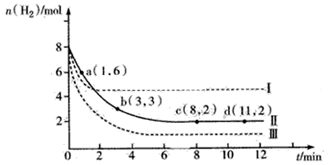
(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是__________。
A.0~1min B.1~3min C.3~8min D.8~11min
(3)求平衡时CO2的转化率 。
(4)在恒温恒容的条件下,下列能说明该反应已经达到平衡状态的是_______。
A.K不变 B.容器内压强保持不变
C.v正(H2)=3v正(CO2) D.容器内的密度保持不变
(5)仅改变某一实验条件再进行实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线Ⅲ对应的实验条件改变是 。
A.升高温度
B.增大压强
C.加入的催化剂
D.降低温度
E.减小压强
-
固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO来生产甲醇燃料的方法: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H = -49.0 kJ·mol-1,
CH3OH(g)+H2O(g) △H = -49.0 kJ·mol-1,
某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。

(1)a点正反应速率_______(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是__________。
A.0~1min B.1~3min C.3~8min D.8~11min
(3)求平衡时CO2的转化率 和该条件下的平衡常数K________。
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是________,曲线II对应的实验条件改变是________。
-
(1)固定和利用CO2能有效地利用资源,并减少空气中的温室气体。工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如右图所示(实线)。图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol。
CH3OH(g)+H2O(g)△H=-49.0kJ·mol-1。某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如右图所示(实线)。图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol。

①下列时间段平均反应速率最大的是__________,最小的是______________。
A.0~1min B.1~3min C.3~8min D.8~11min
②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验改变的条件是________,曲线Ⅱ对应的实验改变的条件是_________。
(2)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,等量的CO2和H2O(g)在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图所示。在0~30 h内,CH4的平均生成速率v(Ⅰ)、v(Ⅱ)和v(Ⅲ)从大到小的顺序为________。反应开始后的12小时内,在第___________种催化剂的作用下,收集的CH4最多。

-
(1)固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.某科学实验将6molCO2和8molH2充入2L密闭容器中,测得H2的物质的量随时间变化如图1所示(实线).图中数据a(1,6)代表的意思是:在l min时H2的物质的量是6mol.
①下列时间段平均反应速率最大的是______,最小的是______.
A.0~1min B.1~3min C.3~8min D.8~11min

②仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中虚线所示,曲线Ⅰ对应的实验改变的条件是______,曲线Ⅱ对应的实验改变的条件是______.
(2)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2.紫外光照射时,等量的CO2和H2O(g)在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如图2所示.在0~30h内,CH4的平均生成速率v(Ⅰ)、v(Ⅱ)和v(Ⅲ)从大到小的顺序为______.反应开始后的12小时内,在第______种催化剂的作用下,收集的CH4最多.
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol,为探究反应原理,现进行如下实验:










