-
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在压强为0.1 MPa条件下,在体积为b L的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
平衡时CO的转化率与温度、压强的关系如下图:
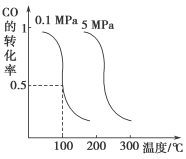
(ⅰ)该反应属于___________反应(填“吸热”或“放热”)。
(ⅱ)100 ℃时,若一个可逆反应的平衡常数K值很大,对此反应的说法正确的是___________(填序号)。
a.该反应使用催化剂意义不大
b.该反应发生将在很短的时间内完成
c.该反应达到平衡时至少有一种反应物百分含量很小
d.该反应一定是放热反应
(ⅲ)在温度和容积不变的情况下,再向平衡体系中充入a mol CO、2a mol H2,达到平衡时CO的转化率___________(填“增大”、“不变”或“减小”,下同),平衡常数___________。
(ⅳ)在某温度下,向一容积不变的密闭容器中充入2.5 mol CO、7.5 mol H2,反应生成CH3OH(g)达到平衡时,CO的转化率为90%,此时容器内压强为开始时压强的___________倍。
(2)某温度下,若将CO2(g)和H2(g)以体积比1∶4混合,在适当压强和催化剂作用下可制得甲烷,已知:
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
H2(g)+1/2O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则CO2(g)和H2(g)反应生成甲烷和液态水的热化学方程式为____________________。
-
(10分)研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。在催化剂作用下,CO可用于合成甲醇:CO(g) + 2H2(g)  CH3OH(g)。
CH3OH(g)。
(1)若在恒温恒压的条件下,向密闭容器中充入4 mol CO和8 mol H2,合成甲醇,平衡时CO的转化率与温度、压强的关系如图所示:

①该反应的正反应属于________反应(填“吸热”或“放热”)。
②在0.1 MPa、100 ℃的条件下,该反应达到平衡时容器内气体的物质的量为_________mol。
(2)若在恒温恒容的条件下,向上述平衡体系中充入4 mol CO,8 mol H2,与(1)相比,达到平衡时CO转化率_______(填“增大”,“不变”或“减小”), 平衡常数K_______(填“增大”,“不变”或“减小”)。
(3)在上述合成甲醇的反应中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:①CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH = +206.2 kJ·mol-1
②CH4(g) + CO2(g) = 2CO(g) + 2H2(g) ΔH = +247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
-
(9分)研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在体积可变的密闭容器中充入4molCO和8molH2,在催化剂作用下合成甲醇:
CO(g)+2H2(g) CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如图所示:
CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如图所示:
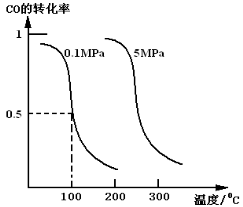
①该反应正向属于________反应;(填“吸热”或放热”)。
②在0.1Mpa 、100℃的条件下,该反应达到平衡时CH3OH体积分数为 。
③在温度和容积不变的情况下,向平衡体系中再充入4molCO,8molH2,达到平衡时CO转化率_______(填“增大”,“不变”或“减小”), 平衡常数K_______(填“增大”,“不变”或“减小”)。
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4(g)+ H2O(g)= CO(g)+3H2(g) △H=+206.2 kJ·mol-1
CH4(g)+ CO2(g)= 2CO(g)+2H2(g) △H=+247.4 kJ·mol-1
则CO和H2O(g)反应生成CO2和H2的热化学方程式为: 。
(3)CO还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液。则该燃料电池放电时,负极的电极反应式为_______________________________。
-
(10分)研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在体积可变的密闭容器中充入4molCO和8molH2,在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g)(Ⅰ),平衡时CO的转化率与温度.压强的关系如图所示:
CH3OH(g)(Ⅰ),平衡时CO的转化率与温度.压强的关系如图所示:
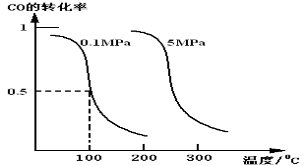
①该反应属于________反应;(填“吸热”或“放热”)
②在0.1Mpa .100℃的条件下,该反应达到平衡时容器体积为开始容器体积的_________倍。(结果保留两位小数点)
③在温度和容积不变的情况下,再向平衡体系中充入4molCO,达到平衡时CO转化率_______(填“增大”, “不变”或“减小”), 平衡常数K_______(填“增大”,“不变”或“减小”)。
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
①CH4(g)+ H2O(g)= CO(g)+3H2(g) △H=+206.2 kJ·mol-1
②CH4(g)+ CO2(g)= 2CO(g)+2H2(g) △H=+247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为:
-
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在体积可变的密闭容器中充入4molCO和8molH2,在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:
CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:

①该反应的逆反应属于________反应;(填“吸热”或“放热”)。
②在0.1Mpa 、100℃的条件下,该反应达到平衡时容器体积为开始容器体积的_________倍。(结果保留两位小数点)
③在温度和容积不变的情况下,再向平衡体系中充入4molCO,达到平衡时CO转化率________(填“增大”,“不变”或“减小”),平衡常数K________(填“增大”,“不变”或“减小”)。
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
①CH4(g)+ H2O(g)= CO(g)+3H2(g) △H=+206.2 kJ·mol-1
②CH4(g)+ CO2(g)= 2CO(g)+2H2(g) △H=+247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
(3)在反应(Ⅰ)中制得的CH3OH 即可以做燃料,还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液。则该燃料电池放电时:负极的电极反应式为____________________。
-
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在体积可变的密闭容器中充入4molCO和8molH2,在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:
CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:

①该反应的逆反应属于________反应;(填“吸热”或“放热”)。
②在0.1Mpa 、100℃的条件下,该反应达到平衡时容器体积为开始容器体积的_________倍。(结果保留两位小数点)
③在温度和容积不变的情况下,再向平衡体系中充入4molCO,达到平衡时CO转化率________(填“增大”,“不变”或“减小”),平衡常数K________(填“增大”,“不变”或“减小”)。
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
①CH4(g)+ H2O(g)= CO(g)+3H2(g) △H=+206.2kJ·mol-1
②CH4(g)+ CO2(g)= 2CO(g)+2H2(g) △H=+247.4kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为:___________________。
(3)在反应(Ⅰ)中制得的CH3OH 即可以做燃料,还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液。则该燃料电池放电时:负极的电极反应式为____________________。
-
研究和开发CO2和CO的创 新利用是环境保护和资源利用双赢的课题。
新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在体积可变的密闭容器中充入4molCO和8molH2,在催化剂作用下合成甲醇:CO(g)+2H2(g) CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:
CH3OH(g)(Ⅰ),平衡时CO的转化率与温度、压强的关系如下图所示:

①该反应的逆反应属于________反应;(填“吸热”或“放热”)。
②在0.1Mpa 、100℃的条件下,该反应达到平衡时容器体积为开始容器体积的_________倍。(结果保留两位小数点)
③在温度和容积不变的情况下,再向平衡体系中充入4molCO,达到平衡时CO转化率________(填“增大”,“不变”或“减小”),平衡常数K________(填“增大”,“不变”或“减小”)。
(2)在反应(Ⅰ)中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
①CH4(g)+ H2O(g)= CO(g)+3H2(g) △H=+206.2 kJ·mol-1
②CH4(g)+ CO2(g)= 2CO(g)+2H2(g) △H=+247.4 kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
(3)在反应(Ⅰ)中制得的CH3OH 即可以做燃料,还可以与氧气组成碱性燃料电池,电解质溶液是20%~30%的KOH溶液。则该燃料电池放电时:负极的电极反应式为____________________。
-
Ⅰ.CO可用于合成甲醇。在压强为0.1MPa条件下,在体积为bL的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:
CO(g)+2H2(g) CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度、压强的关系如下图:
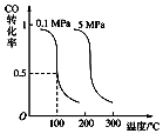
(1)该反应属于 反应(填“吸热”或“放热”)。
(2)100℃时,该反应的平衡常数:K= (用a、b 的代数式表示)。
(3)在温度和容积不变的情况下,再向平衡体系中充入a mol CO,2a mol H2,达到平衡时CO转化率
(填“增大”“不变”或“减小”)
Ⅱ.T ℃时,纯水中c(OH-)为10-6 mol·L-1,则该温度时
(1)将pH=3 的H2SO4溶液与pH=10的NaOH溶液按体积比9:2 混合,所得混合溶液的pH为 。
(2)若1体积pH1=a的某强酸溶液与10体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
Ⅲ. 在25mL的氢氧化钠溶液中逐滴加入0. 2 mol/ L醋酸溶液,滴定曲线如图所示。
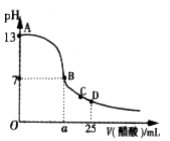
(1)该氢氧化钠溶液浓度为________________。
(2)在B点,a_________12.5 mL(填“<”“>”或“=”)。
(3)在D点,溶液中离子浓度大小关系为_____________________。
-
如何降低大气中CO2的含量及有效地开发利用CO2是当前科学家研究的重要课题。
(1)利用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 molH2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。

①从反应开始到3min时,氢气的平均反应速率v(H2)=_________。
②下列措施中一定能使CO2的转化率增大的是____________。
A.在原容器中再充入1 molCO2 B.在原容器中再充入1molH2
C.在原容器中充入1 molHe D.使用更有效的催化剂
E.缩小容器的容积 F.将水蒸气从体系中分离出
(2)利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) ΔH=akJ/mol,在一定条件下,测得该反应达到平衡状态时的实验数据如表所示。请根据表中数据回答下列问题。
CH3CH2OH(g)+3H2O(g) ΔH=akJ/mol,在一定条件下,测得该反应达到平衡状态时的实验数据如表所示。请根据表中数据回答下列问题。
| 温度(K) CO 2转化率/ (%) 
| 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 80 | 61 | 35 | 21 |
①上述反应的a________0(填“大于”或“小于”)。该反应自发的条件是__________(填“高温”,“低温”,或“任意温度”)。
②恒温下,向反应体系中加入固体催化剂,则反应产生的热量________(填“增大”、“减小”或“不变”)。
③在2L密闭容器中充入1molCO2,在 =3,500K的温度下达到化学平衡时,则反应的平衡常数是_______________。
=3,500K的温度下达到化学平衡时,则反应的平衡常数是_______________。
(3)锂空气电池是前景很广的新颖电池,但锂和空气中的氮气、二氧化碳、水蒸气等发生副反应是锂-空气电池的致命缺陷。所以应在锂金属电极上加一个保护层。该技术的核心是锂表面增加了一层由碳酸锂/碳(Li2CO3/C)组成的致密的保护性涂层。涂层的过程:利用熔融碳酸盐作电解质,直接由锂金属电极与二氧化碳通过 10 次充放电循环,在电极的表面进行化学反应来完成。写出锂电极生成致密保护涂层的电极反应式___________________。利用一种钾盐水溶液作电解质,CO2电催化还原为乙烯,如图所示。在阴极上产生乙烯的电极反应式为_________________。

-
如何降低大气中CO2的含量及有效地开发利用CO2是当前科学家研究的重要课题。
(1)科学家用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 mol H2,在温度一定的条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。

①从反应开始到3 min时,氢气的平均反应速率v(H2)=________。
②下列措施中一定能使CO2的转化率增大的是________。
A.在原容器中再充入1 mol CO2 B.在原容器中再充入1 mol H2
C.在原容器中充入1 mol He D.使用更有效的催化剂
E.缩小容器的容积 F.将水蒸气从体系中分离出
③能说明反应已达平衡状态的是________(填字母,下同)。
A.v(H2)=3v(CO2) B.容器内压强保持不变
C.v逆(CO2)=v正(CH3OH) D.容器内密度保持不变
(2)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。
CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。
|  温度(K) 温度(K)
 CO 2转化率/ (%) CO 2转化率/ (%)
n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
①上述反应的a________0(填“大于”或“小于”)。
②恒温下,向反应体系中加入固体催化剂,则反应产生的热量________(填“增大”“减小”或“不变”)。
③增大 的值,则生成乙醇的物质的量________(填“增大”“减小”“不变”或“不能确定”)。
的值,则生成乙醇的物质的量________(填“增大”“减小”“不变”或“不能确定”)。
CH3OH(g)











