-
(9分)随着环保意识增强,清洁能源越来越受到人们关注。
(1)甲烷是一种理想的洁净燃料。已知:
CH4(g)+2O2(g)= CO2(g)+2H2O(g);△H= —802.3kJ·mol-1
H2O(1) =H2O(g),△H =+44.0kJ·mol-l
则4.8g甲烷气体完全按燃烧生成液态水,放出热量为________。
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。
该反应为CH4(g)+H2O(g) CO(g)+3H2(g);△H=+206.lkJ·mol-l。
CO(g)+3H2(g);△H=+206.lkJ·mol-l。
①若800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表。

则此时正、逆反应速率的关系是________。(填标号)
A.v(正)>v(逆) B.v(正)<v(逆)
C.v(正)=v(逆) D.无法判断
②为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101 kPa或303 kPa,其余实验条件见下表)。
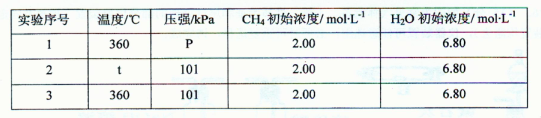
表中t=________ ,P=________ ;
设计实验2、3的目的是________
实验l、2、3中反应的化学平衡常数的大小关系是________ (用K1、K2、K3表示)。
-
随着环保意识的增强,清洁能源越来越受人们关注,
(1)甲烷是一种洁净能源,已知:CH4(g)+2O2(g)═CO2(g)+2H2O(g);△H=-830kJ/mol,H2O(1)=H2O(g);△H=+44kJ/mol,则4.8g甲烷气体燃烧生成液态水放出热量为:______;
(2)利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,该反应:CH4(g)+H20(g)⇌CO(g)+3H2(g)△H=+206.1kJ/mol
①若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0mol/L;c(H2O)=8.5mol,/L;c(CO)=2.0mol/L;c(H2):2.0mol/L,则此时正逆反应的速率关系是:______(填序号)
A.V正>V逆 B.V正<V逆 C.V正=V逆 D.无法判断
②若将温度降至600℃时,此时平衡常数为K2,则K1______K2;(填“>”,“<”或“=”)
(3)利用MnFe2O4作催化剂,通过二步反应可将水分解制得H2,第一步反应为:MnFe2O4 MnFe2O4-x+
MnFe2O4-x+ ↑则框内的物质为:______;第二步反应方程式为:______.
↑则框内的物质为:______;第二步反应方程式为:______.
-
随着环保意识增强,清洁能源越来越受到人们关注.
(1)甲烷是一种理想的洁净燃料.已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ•mol-1
H2O(1)=H2O(g)△H=+44.0kJ•mol-1
则4.8g甲烷气体完全燃烧生成液态水,放出热量为______.
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值.
该反应为CH4(g)+H2O(g) CO(g)+3H2(g)△H=+206.1kJ•mol-1.
①若800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表.
| CH4 | H2O | CO | H2 |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
则此时正、逆反应速率的关系是______.(填下列相关选项的字母符号)
A.v(正)>v(逆) B.v(正)<v(逆)C.v(正)=v(逆)D.无法判断
②为了探究温度、压强对上述化学反应速率的影响,张山同学设计了以下三组对比实验(温度为360℃或480℃、压强为101kPa或303kPa,其余实验条件见下表).
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/mol•L-1 | H2O初始浓度/mol•L-1 | K |
| 1 | 360 | P | 2.00 | 6.80 | K1 |
| 2 | t | 101 | 2.00 | 6.80 | K2 |
| 3 | 360 | 101 | 2.00 | 6.80 | K3 |
表中t=______,P=______;
设计实验2、3的目的是______;
实验l、2、3中反应的化学平衡常数的大小关系是______(用K1、K2、K3表示).
(3)利用催化剂,通过两步反应可将水分解制得氢气,若第一步反应为:MnFe2O4 MnFe2O4-x+
MnFe2O4-x+ □↑,则框内物质为______;
□↑,则框内物质为______;
第二步反应的化学方程式为______(可不写反应条件).
-
随着环保意识增强,清洁能源越来越受到人们关注。
(1)甲烷是一种理想的洁净燃料。已知:CH4(g)+2O2(g)= CO2(g)+ 2H2O(g);△H= -802.3kJ·mol-1 H2O(1)=H2O(g),△H =+44.0kJ·mol-l
写出常温常压下甲烷完全燃烧的热化学方程式____,计算4.8g甲烷气体完全燃烧生成液态水,放出热量为____kJ。
(2)利用甲烷与水反应制备氢气,因原料廉价,具有推广价值。该反应为CH4(g)+H2O(g) CO(g)+3H2(g)△H=+206.lkJ·mol-l。
CO(g)+3H2(g)△H=+206.lkJ·mol-l。
①800℃时,反应的化学平衡常数K=l.0,某时刻测得该温度下密闭容器中各物质的物质的量浓度如下表。
| CH4 | H2O | CO | H2 |
| 3.0 mol•L‾1 | 8.5 mol•L‾1 | 2.0 mol•L‾1 | 2.0 mol•L‾1 |
则此时正、逆反应速率的关系是正反应速率____逆反应速率。(填“>”、“<”、“=”)
②为了探究温度、压强对上述化学反应速率的影响,某同学设计了以下三组对比实验(温度为360℃或480℃、压强为101 kPa或303 kPa,其余实验条件见下表)。
| 实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ mol•L‾1 | H2O初始浓度/ mol•L‾1 |
| 1 | 360 | p | 2.00 | 6.80 |
| 2 | t | 101 | 2.00 | 6.80 |
| 3 | 360 | 101 | 2.00 | 6.80 |
表中t=___,P=____;设计实验2、3的目的是____;实验l、2、3中反应的化学平衡常数的大小关系是____(用K1、K2、K3表示)。
-
随着环保意识的增强,清洁能源越来越受人们关注.
(1)氢能在二十一世纪有可能在世界能源舞台上成为一种举足轻重的二次能源.
①硫-碘循环分解水制氢主要涉及下列反应:
I.SO2+2H2O+I2=H2SO4+2HIⅡ.2HI H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O
H2+I2Ⅲ.2H2SO4=2SO2+O2+2H2O
分析上述反应,下列判断正确的是______(填序号,下同).
a.反应Ⅲ易在常温下进行 b.反应I中SO2氧化性比HI强
c.循环过程中需补充H2O d.循环过程中产生l mol O2的同时产生1mol H2
②利用甲烷与水反应制备氢气,因原料价廉产氢率高,具有实用推广价值,已知该反应为:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ•mol-1若800℃时,反应的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=3.0mol•L-1;c(H2O)=8.5mol•L-1;c(CO)=2.0mol•L-1;c(H2)=2.0mol•L-1,则此时正逆反应速率的关系是v正______v逆.(填“>”、“<”或“=”)
③实验室用Zn和稀硫酸制取H2,反应时溶液中水的电离平衡______移动(填“向左”、“向右”或“不”);若加入少量下列固体试剂中的______,产生H2的速率将增大.
a.NaNO3 b.CuSO4 c.Na2SO4 d.NaHSO3
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) CH3OH(g)分析该反应并回答下列问题:
CH3OH(g)分析该反应并回答下列问题:
①下列各项中,不能说明该反应已达到平衡的是______.
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1mol CO,同时生成l mol CH3OH
②如图甲是该反应在不同温度下CO的转化率随时间变化的曲线.T1和T2温度下的平衡常数大小关系是K1______ K2.(填“>”、“<”或“=”)
③已知甲醇燃料电池的工作原理如图乙所示.
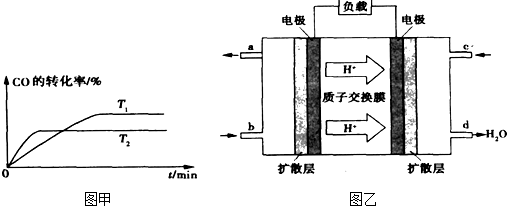
①该电池工作时,b口通入的物质为______,该电池正极的电极反应式为:______,工作一段时间后,当6.4g甲醇(CH3OH)完全反应生成CO2时,有______mol电子发生转移.
-
随着能源与环境问题越来越被人们关注,碳-化学(C1化学)成为研究的热点。“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学与工艺.
(1)将CO2转化成有机物课有效实现碳循环。CO2转化成有机物的例子很多,如:
a.6CO2+6H2O C6H12O6+6O2
C6H12O6+6O2
b.CO2+3H2O CH3OH+H2O
CH3OH+H2O
c.CO2+CH4 CH3COOH
CH3COOH
d.2CO2+6H2 CH2=CH2+4H2O
CH2=CH2+4H2O
在以上属于人工转化的反应中,原子利用率最高的是_______(填序号)。
(2)CO可用于合成甲醇。在压强0.1MPa条件下,在体积为bL的密闭容器中充入 和
和 ,在催化剂作用下合成甲醇:CO(g)+2H2(g)
,在催化剂作用下合成甲醇:CO(g)+2H2(g)  CH3OH(g)。平衡时CO的转化率与温度、压强的关系如图。
CH3OH(g)。平衡时CO的转化率与温度、压强的关系如图。
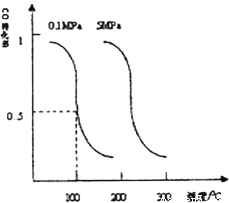
①该反应属于_______反应(填“吸热”或“放热”)。若一个可逆反应的平衡常数K值很大,对此反应的说法正确的是____(填序号)。
a.反应使用催化剂意义不大
b.该反应发生将在很短时间内完成
c.该反应达到平衡时至少有一种反应物百分含量很小
d.该反应一定是放热反应
②100℃时,该反应的平衡常数K=________(用a,b的代数式表示)。
(3)二甲醚(CH3OCH3)被称为21世纪的新型燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
①工业上利用水煤气合成二甲醚的三步反应如下:
a.2H2(g)+CO(g)⇌CH3OH(g) △H1=-90.8kJ•mol-1
b.2CH3OH(g)⇌CH3OCH3(g)+H2O(g)△H2=-23.5kJ•mol-
c.CO(g)+H2O(g)⇌CO2(g0+H2(g)△H3=-41.3kJ•mol
总反应:3H2(g)+3CO(g)⇌CH3OCH3(g)+CO2(g)的△H=___.
②对于反应b,在温度和容积不变的条件下,能说明该反应已达到平衡状态的是_____(填字母)。
a.n(CH3OH)=n(CH3OCH3)=n(H2O)
b.容器内压强保持不变
c.H2O(g)的浓度保持不变
d.CH3OH的消耗速率与CH3OCH3的消耗速率之比为2:1
(4)以KOH溶液为电解质,用二甲醚-空气组成燃料,其中负极的电极反应式为_______。
(5)碳化合物在治理汽车尾气方面也大有可为,如CO、CH4等在一定条件下均可以与氮氧化物生成无污染的物质。写出CO与氮氧化物(NOx)在有催化剂的条件下反应的化学方程式____________。
-
“低碳经济”备受关注,二氧化碳的回收利用是环保和能源领域研究的热点课题。
(1)已知:①CO(g)+H2O(g) H2(g)+CO2(g)△H=-41kJ·mol-1
H2(g)+CO2(g)△H=-41kJ·mol-1
②CH4(g) C(s)+2H2(g)△H=+73kJ·mol-1
C(s)+2H2(g)△H=+73kJ·mol-1
③2CO(g) C(s)+CO2(g)△H=-171kJ·mol-1
C(s)+CO2(g)△H=-171kJ·mol-1
写出CO2与H2反应生成CH4和水蒸气的热化学方程式:_________________________。
(2)CO2与H2在催化剂作用下可以合成二甲醚,反应原理如下:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H。某温度下,向体积为2L的密闭容器中充入CO2与H2,发生上述反应。测得平衡混合物中CH3OCH3(g)的体积分数[φ(CH3OCH3) 与起始投料比Z[Z=
CH3OCH3(g)+3H2O(g) △H。某温度下,向体积为2L的密闭容器中充入CO2与H2,发生上述反应。测得平衡混合物中CH3OCH3(g)的体积分数[φ(CH3OCH3) 与起始投料比Z[Z= ]的关系如图1所示;CO2的平衡转化率(a)与温度(T)、压强(p)的关系如图2所示。
]的关系如图1所示;CO2的平衡转化率(a)与温度(T)、压强(p)的关系如图2所示。
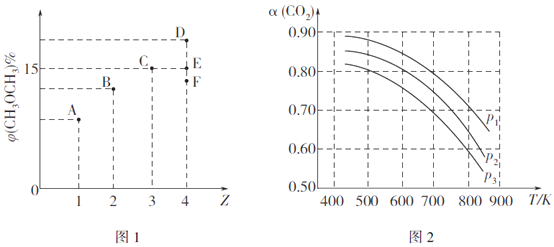
①当Z=3时,CO2的平衡转化率a=__________%。
②当Z=4时,反应达到平衡状态后,CH3OCH3的体积分数可能是图1中的_________点(填"D"、"E"或“F")。
③由图2可知该反应的△H_______0(选填“>”、“<“或“=”,下同),压强p1、p2、p3由大到小的顺序为__________。
④若要进一步提高H2的平衡转化率,除了可以适当改变反应温度和压强外,还可以采取的措施
有________________(任写一种)。
(3)我国科研人员研制出的可充电"Na-CO2"电池,以钠箔和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示。
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图3所示。
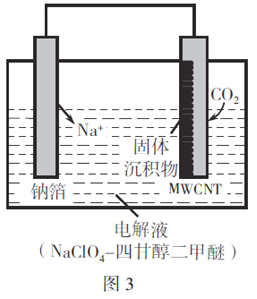
①放电时,正极的电极反应式为____________________。
②若生成的Na2CO3和C全部沉积在正极表面,当正极增加的质量为28g时,转移电子的物质的量为__________。
③可选用高氯酸钠-四甘醇甲醚作电解液的理由是________________________。
-
随着科技进步和人类环保意识的增强,如何利用CO2已经成为世界各国特别关注的问题。
已知:CO2与CH4经催化重整制得合成气:CH4(g)+CO2(g)  2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
(1)降低温度,该反应速率会_______________(填“增大”或“减小”);一定压强下,由最稳定单质生1 mol化合物的焓变为该物质的摩尔生成焓。已知CO2(g)、CH4(g)、CO(g)的摩尔生成焓分别为-395 kJ/mol、-74.9 kJ/mol、-110.4 kJ/mol。则上述重整反应的ΔH=____________kJ/mol。
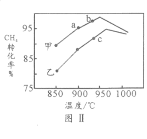
(2)T1℃时,在两个相同刚性密闭容器中充入CH4和CO2分压均为20 kPa,加入催化剂Ni/α-Al2O3并分别在T1℃和T2℃进行反应,测得CH4转化率随时间变化如图Ⅰ所示。
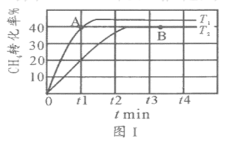
①A点处v正_______B点处(填“<”、“>”或“=”)
②研究表明CO的生成速率v生成(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,A点处v生成(CO)=__________mol·g-1·s-1。
(3)上述反应达到平衡后,若改变某一条件,下列变化能说明平衡一定正向移动的是________________(填代号)。
A.正反应速率增大 B.生成物的百分含量增大 C.平衡常数K增大
(4)其他条件相同,在甲、乙两种不同催化剂作用下,相同时间内测得CH4转化率与温度变化关系如图Ⅱ,C点___________________(填“可能”、“一定”或“一定未”)达到平衡状态,理由是_____________;CH4的转化率b点高于a点的可能原因是_________________________________。
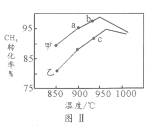
-
随着科技进步和人类环保意识的增强,如何利用CO2已经成为世界各国特别关注的问题。
已知:CO2与CH4经催化重整制得合成气:CH4(g)+CO2(g)  2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
(1)降低温度,该反应速率会_______________(填“增大”或“减小”);一定压强下,由最稳定单质生1 mol化合物的焓变为该物质的摩尔生成焓。已知CO2(g)、CH4(g)、CO(g)的摩尔生成焓分别为-395 kJ/mol、-74.9 kJ/mol、-110.4 kJ/mol。则上述重整反应的ΔH=____________kJ/mol。
(2)T1℃时,在两个相同刚性密闭容器中充入CH4和CO2分压均为20 kPa,加入催化剂Ni/α-Al2O3并分别在T1℃和T2℃进行反应,测得CH4转化率随时间变化如图Ⅰ所示。
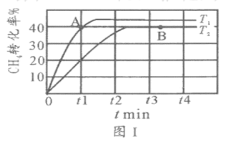
①A点处v正_______B点处(填“<”、“>”或“=”)
②研究表明CO的生成速率v生成(CO)=1.3×10-2·p(CH4)·p(CO2)mol·g-1·s-1,A点处v生成(CO)=__________mol·g-1·s-1。
(3)上述反应达到平衡后,若改变某一条件,下列变化能说明平衡一定正向移动的是________________(填代号)。
A.正反应速率增大 B.生成物的百分含量增大 C.平衡常数K增大
(4)其他条件相同,在甲、乙两种不同催化剂作用下,相同时间内测得CH4转化率与温度变化关系如图Ⅱ,C点___________________(填“可能”、“一定”或“一定未”)达到平衡状态,理由是_____________;CH4的转化率b点高于a点的可能原因是_________________________________。
-
能源是人类共同关注的重要问题。页岩气是从页岩层中开采出来的一种非常重要的天然气资源,页岩气的主要成分是甲烷,是公认的洁净能源。
(1)页岩气不仅能用作燃料,还可用于生产合成气(CO和H2)。CH4与H2O(g)通入聚焦太阳能反应器,发生反应 CH4(g)+H2O(g)=CO(g)+3H2(g)△H1
已知:①CH4、H2、CO 的燃烧热(△H)分别为-a kJ•mol-1、-b kJ•mol-1、-c kJ•mol-1;
②H2O (l) =H2O(g); △H=+dkJ•mol-1
则△H1= ___________(用含字母a、b、c、d的代数式表示)kJ•mol-1。
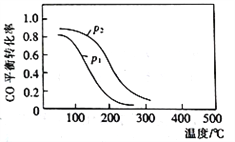
(2)用合成气生成甲醇的反应为:CO(g)+2H2(g) CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
CH3OH(g) △H2,在10L恒容密闭容器中按物质的量之比1∶2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如下图所示,200℃时n(H2)随时间的变化如下表所示:
| t/min | 0 | 1 | 3 | 5 |
| n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①△H2_________ (填“>”“<”或“ = ”)0。
②下列说法正确的是____________ (填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强p1<p2
③ 0〜3 min内用CH3OH表示的反应速率v(CH3OH)=________mol • L-1·min-1。
④ 200℃时,该反应的平衡常数K =_______。向上述200℃达到平衡的恒容密闭容器中再加入2 mol CO、2 mol H2、2 mol CH3OH,保持温度不变,则化学平衡____________(填“正向”、“逆向”或“不”)移动。
(3)甲烷、氧气和KOH溶液可组成燃料电池。标准状况下通入5.6 L甲烷,测得电路中转移1.2 mol电子,则甲烷的利用率为_________。










