-
(1)化学平衡常数K表示可逆反应进行程度,K值越大,表示  ,K值大小与温度的关系是:△H<0(正反应放热),当温度升高K值 。
,K值大小与温度的关系是:△H<0(正反应放热),当温度升高K值 。
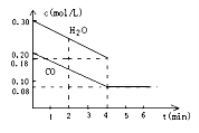
(2)在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g) + H2O(g) CO2(g)+H2(g) △H<0,CO和H2O浓度变化如下图所示,则0~4min的平均速率v(CO)= 。
CO2(g)+H2(g) △H<0,CO和H2O浓度变化如下图所示,则0~4min的平均速率v(CO)= 。
(3)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。
t1℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
①表中3~4min反应处于 状态;c1数值 0.08mol/L(填“>”“<”“=”)
②反应在4~5min,平衡向逆方向移动,可能的原因是 (单选),表中5~6min数值发生变化,可能的原因是 (单选)
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
-
(12分)
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示可逆反应进行得越完全,K值大小与温度的关系是:温度升高,K值 (填“一定增大”、“一定减小”或“可能增大也可能减小”)。
(2)在一体积为10 L的容器中,通入一定量的CO和H2O,在800℃时发生如下反应:
CO(g)+H2O(g) CO2(g)+H2(g)ΔH<0,CO和H2O的物质的量浓度变化如图所示,则:
CO2(g)+H2(g)ΔH<0,CO和H2O的物质的量浓度变化如图所示,则:
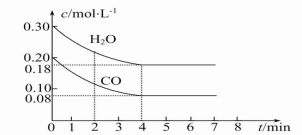
①0~4 min时间段平均反应速率v(CO)= mol·L-1·min-1。
②在800℃时该反应的化学平衡常数K= (要求写出表达式及数值),CO的转化率= 。
③在800℃时,若反应开始时此容器中CO和H2O的浓度分别为0.20 mol·L-1和0.80 mol·L-1,则达到平衡时CO转化为CO2的转化率是 。
-
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示________;K值大小与温度的关系是:温度升高,K值________(填“一定增大”、“一定减小”、或“可能增大也可能减小”).
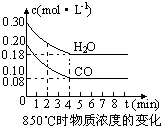
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)⇌CO2(g)+H2 (g)△H<0 CO和H2O浓度变化如右图,则 0-4min的平均反应速率v(CO)=________,该温度下平衡常数K的数值为________.
(3)t1℃(t1>850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表.
①表中3min-4min之间反应处于________状态; c1数值________0.08mol/L (填大于、小于或等于).
②反应在4min-5min间,平衡向逆方向移动,可能的原因是________(单选),表中5min-6min之间数值发生变化,可能的原因是________(单选).a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度 | 时间(min) | CO | H2O | CO2 | H2 |
| 0.200 | 0.300 | | |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
-
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示________;K值大小与温度的关系是:温度升高,K值________(填“一定增大”、“一定减小”、或“可能增大也可能减小”).
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)⇌CO2(g)+H2 (g)△H<0 CO和H2O浓度变化如右图,则 0-4min的平均反应速率v(CO)=________,该温度下平衡常数K的数值为________.
(3)t1℃(t1>850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表.
①表中3min-4min之间反应处于________状态; c1数值________0.08mol/L (填大于、小于或等于).
②反应在4min-5min间,平衡向逆方向移动,可能的原因是________(单选),表中5min-6min之间数值发生变化,可能的原因是________(单选).a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度 | 时间(min) | CO | H2O | CO2 | H2 |
| 0.200 | 0.300 | | |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
-
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示, K值大小与温度的关系是:温度升高,K值 。(填一定增大、一定减小、或可能增大也可能减小)。
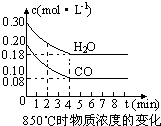
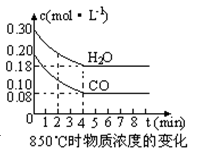
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g) +H2O(g)  CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=mol·L-1·min-1。t℃时物质浓度(mol·L-1)的变化:
CO2(g) +H2 (g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)=mol·L-1·min-1。t℃时物质浓度(mol·L-1)的变化:
| 时间(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min~4min之间反应处于 状态;c 1数值 0.08 mol·L-1 (填大于、小于或等于)。
②反应在4min~5min间,平衡向逆方向移动,可能的原因是 (单选),表中5min~6min之间数值发生变化,可能的原因是 (单选)。
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
-
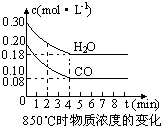
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示________;K值大小与温度的关系是:温度升高,K值________(填“一定增大”、“一定减小”、或“可能增大也可能减小”).
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)⇌CO2(g)+H2 (g)△H<0 CO和H2O浓度变化如右图,则 0-4min的平均反应速率v(CO)=________,该温度下平衡常数K的数值为________.
(3)t1℃(t1>850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如右表.
①表中3min-4min之间反应处于________状态; c1数值________0.08mol/L (填大于、小于或等于).
②反应在4min-5min间,平衡向逆方向移动,可能的原因是________(单选),表中5min-6min之间数值发生变化,可能的原因是________(单选).a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度 | 时间(min) | CO | H2O | CO2 | H2 |
| 0.200 | 0.300 | | |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c3 |
| 4 | c1 | c2 | c3 | c3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
-
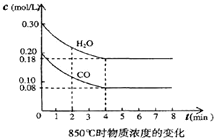
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示______,K值大小与温度的关系是:温度升高,K值______ (填一定增大、一定减小、或可能增大也可能减小).
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g)+H2O(g)⇌CO2(g)+H2 (g)△H<0.CO和H2O浓度变化如下图所示,则0~4min的平均反应速率v(CO)=______mol/
t1℃时物质浓度(mol/L)的变化
| 时间(min) | CO | H2O | CO2 | H2 |
| 0.200 | 0.300 | | |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.006 | 0.266 | 0.104 | |
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表.
①表中3min~4min之间反应处于______状态;C1数值______0.08mol/L (填大于、小于或等于).
②反应在4min~5min之间,平衡向逆方向移动,可能的原因是______ (单选),表中5min~6min之间数值发生变化,可能的原因是______ (单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度.
-
(1)平衡常数K表示可逆反应的进行程度,K值越大,表示________
(2)大小与温度的关系是:温度升高,K值________(填一定增大、一定减小、或可能增大也可能减小).
-
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示________,K值大小与温度的关系是:温度升高,K值_______。(填增大、减小、不变、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:CO(g) + H2O(g)  CO2(g) + H2(g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)= mol·L-1·min-1。
CO2(g) + H2(g) △H<0,CO和H2O浓度变化如下图,则0~4min的平均反应速率v(CO)= mol·L-1·min-1。
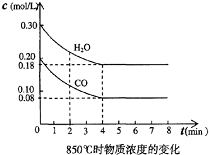
(3 )t℃(高于850℃ ),在相同容器中发生上述反应,容器内各物质变化如下表。
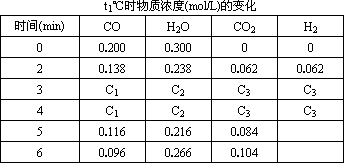
①表中3 min~4 min之间反应________(达到平衡,正向进行,逆向进行);C1数值________0.08 mol·L-1(填大于、小于或等于)。
②反应在4 min~5 min问,平衡向逆方向移动,可能的原因是________(单选),表中5 min~6 min之间数值发生变化,可能的原因是________(单选).
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
-
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示________
________,K值大小与温度的关系是:温度升高,K值________ (填一定增大、一定减小、或可能增大也可能减小).
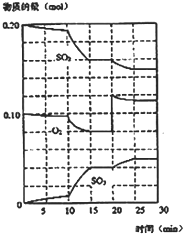
(2)在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+O2 (g)⇌2SO3(g)△H<0
①写出该反应的化学平衡常数表达式 K=________.
②降低温度,该反应K值________,二氧化硫转化率________,化学反应速率
________(以上均填增大、减小或不变)
③600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间段是________;________.
④据图判断,反应进行至20min时,曲线发生变化的原因是________(用文字表达)
,K值大小与温度的关系是:△H<0(正反应放热),当温度升高K值 。
CO2(g)+H2(g) △H<0,CO和H2O浓度变化如下图所示,则0~4min的平均速率v(CO)= 。









