-
某研究小组探究在加热条件下FeSO4分解的气体产物及相关性质。已知:SO2的沸点为-10℃、SO3的沸点为44.8℃。
Ⅰ.用如图所示装置设计实验,验证分解FeSO4生成的气态产物。
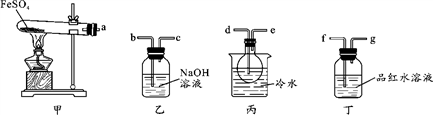
(1)实验前必须进行的操作是_____________________________________。
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:a→_________________。
(3)若观察到装置丙中有无色液体产生,装置丁中溶液变成无色,则 FeSO4分解的化学方程式为__________________________________________。
Ⅱ.为探究SO2使品红溶液褪色的原理,进行如下实验:
实验1:将稀盐酸和NaOH溶液分别滴入品红水溶液中。观察到前者溶液颜色变浅,但未能完全褪色,后者溶液颜色几乎不变。
实验2:在滴有稀盐酸和NaOH溶液的两份品红水溶液中分别通入SO2。观察到前者溶液逐渐褪色,后者溶液很快褪色。
实验3:在两份品红水溶液中分别加入一小粒Na2SO3固体和NaHSO3固体,前者溶液很快褪色,后者溶液褪色很慢。
(1)由实验1可推测品红水溶液呈________性。
(2)由实验2、3可推知,使品红水溶液褪色的主要微粒是_________(填化学式)。
(3)若将SO2通入品红的无水乙醇溶液,试预测可能出现的现象_____________________。
(4)加热溶有Na2SO3的品红水溶液,发现不能恢复红色,试解释原因
_________________________________________________________________________。
-
某研究小组探究在加热条件下FeSO4分解的气体产物及相关性质。已知:SO2的沸点为-10℃、SO3的沸点为44.8℃。
Ⅰ.用如图所示装置设计实验,验证分解FeSO4生成的气态产物。
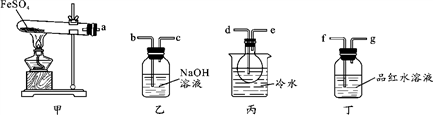
(1)实验前必须进行的操作是_____________________________________。
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:a→_________________。
(3)若观察到装置丙中有无色液体产生,装置丁中溶液变成无色,则 FeSO4分解的化学方程式为__________________________________________。
Ⅱ.为探究SO2使品红溶液褪色的原理,进行如下实验:
实验1:将稀盐酸和NaOH溶液分别滴入品红水溶液中。观察到前者溶液颜色变浅,但未能完全褪色,后者溶液颜色几乎不变。
实验2:在滴有稀盐酸和NaOH溶液的两份品红水溶液中分别通入SO2。观察到前者溶液逐渐褪色,后者溶液很快褪色。
实验3:在两份品红水溶液中分别加入一小粒Na2SO3固体和NaHSO3固体,前者溶液很快褪色,后者溶液褪色很慢。
(1)由实验1可推测品红水溶液呈________性。
(2)由实验2、3可推知,使品红水溶液褪色的主要微粒是_________(填化学式)。
(3)若将SO2通入品红的无水乙醇溶液,试预测可能出现的现象_____________________。
(4)加热溶有Na2SO3的品红水溶液,发现不能恢复红色,试解释原因
_________________________________________________________________________。
-
某研究小组探究在加热条件下FeSO4分解的气体产物及相关性质。已知:SO2的沸点为-10℃、SO3的沸点为44.8℃。
Ⅰ.用如图所示装置设计实验,验证分解FeSO4生成的气态产物。
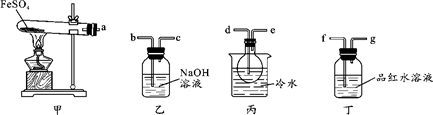
(1)实验前必须进行的操作是_____________________________________。
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:a→_________________。
(3)若观察到装置丙中有无色液体产生,装置丁中溶液变成无色,则 FeSO4分解的化学方程式为__________________________________________。
Ⅱ.为探究SO2使品红溶液褪色的原理,进行如下实验:
实验1:将稀盐酸和NaOH溶液分别滴入品红水溶液中。观察到前者溶液颜色变浅,但未能完全褪色,后者溶液颜色几乎不变。
实验2:在滴有稀盐酸和NaOH溶液的两份品红水溶液中分别通入SO2。观察到前者溶液逐渐褪色,后者溶液很快褪色。
实验3:在两份品红水溶液中分别加入一小粒Na2SO3固体和NaHSO3固体,前者溶液很快褪色,后者溶液褪色很慢。
(1)由实验1可推测品红水溶液呈________性。
(2)由实验2、3可推知,使品红水溶液褪色的主要微粒是_________(填化学式)。
(3)若将SO2通入品红的无水乙醇溶液,试预测可能出现的现象_____________________。
(4)加热溶有Na2SO3的品红水溶液,发现不能恢复红色,试解释原因
_________________________________________________________________________。
-
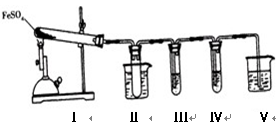
已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2。某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物。已知SO3的熔点是16.8℃,沸点是44.8℃。
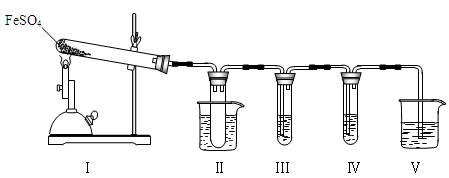
(1)装置Ⅱ的试管中不装任何试剂,其作用是_______________________,试管浸泡在50℃的水浴中,目的是________________________________。
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分。请完成实验设计,填写检验试剂、预期现象与结论。
限选试剂:3 mol·L-1 H2SO4、6 mol·L-1 NaOH、0.5 mol·L-1 BaCl2、0.5 mol·L-1 Ba(NO3)2、0.01 mol·L-1酸性KMnO4溶液、0.01 mol·L-1溴水。
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入________________。 | 产生大量白色沉淀,证明气体产物中含有SO3。 |
| 装置Ⅳ的试管中加入________________。 | ______________________________ ______________________________ ______________________________ ______________________________ |
(3)装置Ⅴ的作用是防止尾气污染环境,烧杯中应加入的试剂是 。
-
已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2.某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物.已知SO3的熔点是16.8℃,沸点是44.8℃.

(1)装置Ⅱ的试管中不装任何试剂,其作用是______,试管浸泡在50℃的水浴中,目的是______.
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.限选试剂:3mol•L-1 H2SO4、6mol•L-1 NaOH、0.5mol•L-1 BaCl2、0.5mol•L-1 Ba(NO3)2、0.01mol•L-1酸性KMnO4溶液、0.01mol•L-1溴水.
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入______. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置Ⅳ的试管中加入______. | ______
|
(3)装置Ⅴ的作用是防止尾气污染环境,烧杯中应加入的试剂是______.
-
(9分)、已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2。某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物。已知SO3的熔点是16.8℃,沸点是44.8℃
⑴装置Ⅱ的试管中不装任何试剂,其作用是________。试管浸泡在50℃的水浴中,目的是________。
| 检验试剂 | 预期现象与结论 |
| 装置Ⅲ的试管中加入________。 | 产生大量白色沉淀,证明气体产物中含有SO3 |
| 装置Ⅳ的试管中加入________。 | ________ ________ |
⑵装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分。请完成实验设计,填写检验试剂、预期现象与结论。限选试剂:3mol·L-1H2SO4、6 mol·L-1NaOH、0.5 mol·L-1BaCl2、0.5 mol·L-1Ba(NO3)2、0.01 mol·L-1酸性KMnO4溶液、0.01 mol·L-1溴水
⑶装置Ⅴ的作用是防止尾气污染环境,烧杯中应加入的试剂是________。
-
(16分)已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2。某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物。已知SO3的熔点是16.8℃,沸点是44.8℃。

(1)装置Ⅱ的试管中不装任何试剂,其作用是______________________________
试管浸泡在50℃的水浴中,目的是______________________________________
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分。请完成实验设计,填写检验试剂、预期现象与结论。
限选试剂:3 mol·L-1 H2SO4、6 mol·L-1 NaOH、0.5 mol·L-1 BaCl2、0.5 mol·L-1 Ba(NO3)2、
0.01 mol·L-1酸性KMnO4溶液、0.01 mol·L-1溴水。
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入_____________________。 | 产生大量白色沉淀,证明气体产物中含有SO3。 |
| 装置Ⅳ的试管中加入________________________。 | ______________________________________ ______________________________________ ______________________________________ ______________________________________ |
(3)装置Ⅴ的作用是防止尾气污染环境,烧杯中应加入的试剂是________。
-
硫酸亚铁晶体(FeSO4·xH2O)是制备多种药物的重要原料,受热易分解。(1)甲组同学设计 如下图所示装置,探究硫酸亚铁晶体受热分解产物和结晶水含量。已知:SO3的熔点为16.8℃,沸点是44.8℃;能被浓硫酸充分吸收;溶于水放出大量热,易形成酸雾。
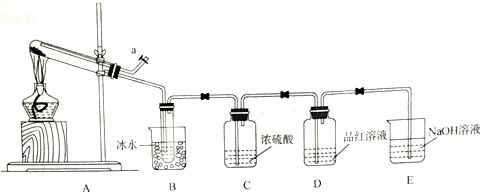
①装置B的作用 。
②点燃酒精灯之前,需在a处向装置中通入一段时间的N2,目的为 。
③实验过程中,观察到装置C中产生少许酸雾,装置D中品红溶液褪色,则分解产物中一定有 (填化学式)
④若实验开始前,向试管中加入27.8g硫酸亚铁晶体,充分分解后,停止加热至试管冷却,测得B、C共增重16.6g。试管冷却过程中,同时需要进行的操作为 。
⑤进一步检验装置A中残留固体成分:取少量固体,溶于适量稀硫酸,滴加酸性KMnO4溶液,无明显现象,则生成固体的俗名为 。
⑥通过上述实验,可得出n(FeSO4·xH2O)= (列出表达式并计算);该晶体分解的化学方程式为
(2)乙组同学为证明酸性:H2SO3>H2CO3>H2SiO3,选用甲组实验中的装置A、B、C和下图所示的部分装置进行实验。
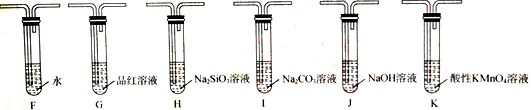
①乙组同学的实验装置中,依次连接的合理顺序为A、B、C、 (填装置字母)
②能证明H2CO3的酸性强于H2SiO3的现象为: 。
-
过硫酸钠(Na2S2O8)具有极强的氧化性,且不稳定,某化学兴趣小组探究过硫酸钠的相关性质,实验如下。已知SO3是无色易挥发的固体,熔点16.8℃,沸点44.8℃。
(1)稳定性探究(装置如图):
分解原理:2Na2S2O8 2Na2SO4+2SO3↑+O2↑。
2Na2SO4+2SO3↑+O2↑。
此装置有明显错误之处,请改正:______________________,水槽冰水浴的目的是____________________;带火星的木条的现象_______________。

(2)过硫酸钠在酸性环境下,在Ag+的催化作用下可以把Mn2+氧化为紫红色的离子,所得溶液加入BaCl2可以产生白色沉淀,该反应的离子方程式为______________________,该反应的氧化剂是______________,氧化产物是________。
(3)向上述溶液中加入足量的BaCl2,过滤后对沉淀进行洗涤的操作是___________________________。
(4)可用H2C2O4溶液滴定产生的紫红色离子,取20mL待测液,消耗0.1mol·L-1的H2C2O4溶液30mL,则上述溶液中紫红色离子的浓度为______mol·L-1,若Na2S2O8有剩余,则测得的紫红色离子浓度将________(填“偏高”“偏低”或“不变”)。
-
某小组取一定质量的FeSO4固体,利用下图装置进行实验。
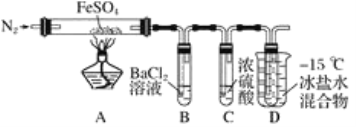

已知:SO2熔点-72℃,沸点-10℃;SO3熔点16.8℃,沸点44.8 ℃。
(1)实验③反应的离子方程式是_________________________。
(2)分解过程除产生使木条复燃的气体外,仅由A中固体颜色变化推测,还一定有________气体,依据是________________________________。
(3)实验④反应的离子方程式是__________________________。
(4)某同学依据B中的现象,认为FeSO4分解一定有SO3生成。你认为是否正确,并说明原因:____________(用必要的文字和化学方程式解释)。











