-
以钡矿粉(主要成份为BaCO3,含有Ca2+、Fe2+、Fe3+、Mg2+等)制备BaCl2·2H2O的流程如下:
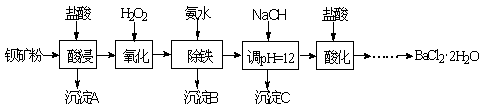
(1)氧化过程主要反应的离子方程式为________。
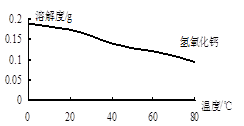
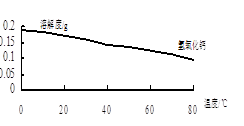
(2)沉淀C的主要成分是Ca(OH)2和________。由图可知,为了更好的使Ca2+沉淀,还应采取的措施为________。

(3)用BaSO4重量法测定产品纯度的步骤为:
步骤1:准确称取0.4~0.6 g BaCl2·2H2O试样,加入100 ml 水,3 ml 2 mol·L-1 的HCl溶液加热溶解。
步骤2:边搅拌,边逐滴加入0.1 mol·L-1 H2SO4溶液。
步骤3:待BaSO4沉降后,________,确认已完全沉淀。
步骤4:过滤,用0.01 mol·L-1的稀H2SO4洗涤沉淀3~4次,直至洗涤液中不含Cl-为止。
步骤5:将折叠的沉淀滤纸包置于________中,经烘干、炭化、灰化后在800℃灼烧至恒重。称量计算BaCl2·2H2O中Ba2+的含量。
①步骤3所缺的操作为________。
②若步骤1称量的样品过少,则在步骤4洗涤时可能造成的影响为________。
③步骤5所用瓷质仪器名称为________。滤纸灰化时空气要充足,否则BaSO4易被残留的炭还原生成BaS,该反应的化学方程式为________。
④有同学认为用K2CrO4代替H2SO4作沉淀剂效果更好,请说明原因________。
[已知:Ksp(BaSO4)=1.1×10-10 Ksp(BaCrO4)=1.2×10-10]
-
以钡矿粉(主要成份为BaCO3,含有Ca2+、Fe2+、Fe3+、Mg2+等)制备BaCl2·2H2O的流程如下:
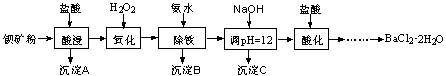
(1)氧化过程主要反应的离子方程式为________。
(2)沉淀C的主要成分是Ca(OH)2和________。
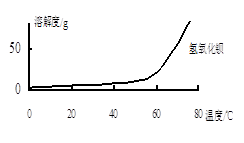
由图可知,为了更好的使Ca2+沉淀,还应采取的措施为________。
(3)用BaSO4重量法测定产品纯度的步骤为:
步骤1:准确称取0.4~0.6 g BaCl2·2H2O试样,加入100 ml 水,3 ml 2 mol·L-1 的HCl溶液加热溶解。
步骤2:边搅拌,边逐滴加入0.1 mol·L-1 H2SO4溶液。
步骤3:待BaSO4沉降后,________,确认已完全沉淀。
步骤4:过滤,用0.01 mol·L-1的稀H2SO4洗涤沉淀3~4次,直至洗涤液中不含Cl-为止。
步骤5:将折叠的沉淀滤纸包置于________中,经烘干、炭化、灰化后在800℃灼烧至恒重。称量计算BaCl2·2H2O中Ba2+的含量。
①步骤3所缺的操作为________。
②若步骤1称量的样品过少,则在步骤4洗涤时可能造成的影响为________。
③步骤5所用瓷质仪器名称为________。滤纸灰化时空气要充足,否则BaSO4易被残留的炭还原生成BaS,该反应的化学方程式为________。
④有同学认为用K2CrO4代替H2SO4作沉淀剂效果更好,请说明原因________。
[已知:Ksp(BaSO4)=1.1×10-10 Ksp(BaCrO4)=1.2×10-10]
-
以钡矿粉(主要成份为BaCO3,含有Ca2+、Fe2+、Fe3+、Mg2+等)制备BaCl2•2H2O的流程如下:
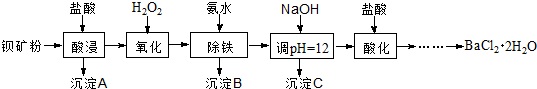
(1)氧化过程主要反应的离子方程式为________.
(2)沉淀C的主要成分是Ca(OH)2和________.由图可知,为了更好的使Ca2+沉淀,还应采取的措施为________.
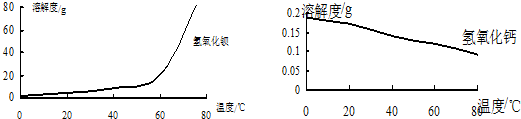
(3)用BaSO4重量法测定产品纯度的步骤为:
步骤1:准确称取0.4~0.6g BaCl2•2H2O试样,加入100ml 水,3ml 2mol•L-1 的HCl溶液加热溶解.
步骤2:边搅拌,边逐滴加入0.1mol•L-1 H2SO4溶液.
步骤3:待BaSO4沉降后,________,确认已完全沉淀.
步骤4:过滤,用0.01mol•L-1的稀H2SO4洗涤沉淀3~4次,直至洗涤液中不含Cl-为止.
步骤5:将折叠的沉淀滤纸包置于________中,经烘干、炭化、灰化后在800℃灼烧至恒重.称量计算BaCl2•2H2O中Ba2+的含量.
①步骤3所缺的操作为________.
②若步骤1称量的样品过少,则在步骤4洗涤时可能造成的影响为________.
③步骤5所用瓷质仪器名称为________.滤纸灰化时空气要充足,否则BaSO4易被残留的炭还原生成BaS,该反应的化学方程式为________.
④有同学认为用K2CrO4代替H2SO4作沉淀剂效果更好,请说明原因________.
[已知:Ksp(BaSO4)=1.1×10-10 Ksp(BaCrO4)=1.2×10-10].
-
氟化钡可用于制造电机电刷、光学玻璃、光导纤维、激光发生器。以钡矿粉(主要成份为BaCO3,含有SiO2、Fe2+、Mg2+等杂质)制备氟化钡的流程如下:
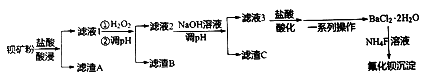
已知:常温下Fe3+、Mg2+完全沉淀的pH分别是:3.4、12.4。
(1)滤渣A的化学式为_____
(2)滤液1加H2O2氧化过程主要反应的离子方程式为_______________________。
(3)加20%NaOH溶液调节pH=12.5,得到滤渣C的主要成分是____________________。
(4)滤液3加入盐酸酸化后再经_____、冷却结晶、_______、洗涤,真空干燥等一系列操作后得到BaCl2·2H2O晶体。
(5)常温下,用BaCl2·2H2O配制成0.2mol/L水溶液与等浓度的氟化铵溶液反应,可得到氟化钡沉淀。请写出该反应的离子方程式__________________。己知Ksp(BaF2)=1.84×10-7,当钡离子完全沉淀时(即钡离子浓度≤10-5L),至少需要的氟离子浓度是_____ mol/L (结果保留三位有效数字)。(己知 =1.36)
=1.36)
(6)己知:Ksp (BaCO3 =2.58×10-9,Ksp (BaSO4)=1.07×10-10。将氯化钡溶液滴入等物质的量浓度的硫酸钠和碳酸钠混合液中,当BaCO3开始沉淀时,溶液中 =_______。(结果保留三位有效数字)
=_______。(结果保留三位有效数字)
-
毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2∙2H2O的流程如下:

| Ca2+ | Mg2+ | Fe3+ |
| 开始沉淀的pH |  11.9 11.9
| 9.1 | 1.9[ |
| 完全沉淀的pH | 13.9 | 11.1 | 3.2 |
已知:Ksp(BaC2O4)= 1.6×10–7,Ksp(CaC2O4)= 2.3×10–9
(1)实验室用37%的盐酸配制1mol/L盐酸,下列仪器中,不需要使用的是_______ __
a.容量瓶 b.量筒  c.烧杯 d.滴定管
c.烧杯 d.滴定管
为了加快毒重石的酸浸速率,可以采取的措施有______________(至少两条)。
(2)加入氨水调节溶液pH=8的目的是___________________________。滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是___ __ ____________。
(3)操作Ⅳ的步骤是:______ ______、过滤。
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42—+2H+=Cr2O72—+H2O ;Ba2++CrO42— =BaCrO4↓
步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点 ,测得滴加盐酸体积为V0 mL。
,测得滴加盐酸体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
通过计算,氯化钡溶液浓度为___________mol·L-1(用含字母的式子表示)。
-
毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2∙2H2O的流程如下:

| Ca2+ | Mg2+ | Fe3+ |
| 开始沉淀的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀的pH | 13.9 | 11.1 | 3.2 |
已知:Ksp(BaC2O4)= 1.6×10–7,Ksp(CaC2O4)= 2.3×10–9
(1)实验室用37%的盐酸配制1mol/L盐酸,除烧杯外,还需要使用下列玻璃仪器中的:______________。
a.容量瓶 b.量筒 c.玻璃棒 d.滴定管
为了加快毒重石的酸浸速率,可以采取的措施有:_______________________。(至少两条)
(2)加入氨水调节溶液pH=8的目的是:________________________________。滤渣Ⅱ中含__________(填化学式)。加入H2C2O4时应避免过量,原因是:_____________________________。
(3)操作Ⅳ的步骤是:蒸发浓缩、冷却结晶、____________。
(4)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42—+2H+=Cr2O72—+H2O Ba2++CrO42—=BaCrO4↓
步骤Ⅰ 移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。
氯化钡溶液浓度为______________________ mol·L-1(用含字母的式子表示)。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则Ba2+浓度的测量值将___________(填“偏大”或“偏小”)。
-
(19分)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
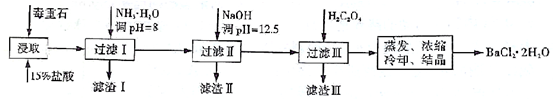
(1)毒重石用盐酸浸取前需充分研磨,目的是 。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的 。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)
| Ca2+ | Mg2+ | Fe3+ |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
加入NH3·H2O调节pH=8可除去 (填离子符号),滤渣Ⅱ中含 (填化学式)。加入H2C2O4时应避免过量,原因是 。
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
(3)利用简洁酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42—+2H+=Cr2O72—+H20 Ba2++CrO42—=BaCrO4↓
步骤I:移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL。
步骤II:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的 (填“上方”或“下方”)。BaCl2溶液的浓度为 mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将 (填“偏大”或“偏小”)。
-
毒重石的主要成分 BaCO3(含 Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备 BaCl2·2H2O 的流程如下:
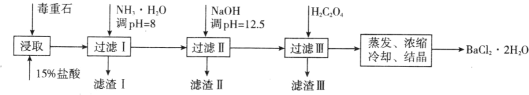
(1)毒重石用盐酸浸取前需充分研磨,目的是_______。实验室用 37%的盐酸配制 15%的盐酸,除量筒外还需使用下列仪器中的_______(填标号)。
a 烧杯 b 容量瓶 c 玻璃棒 d 滴定管
(2)
| Ca2+ | Mg2 + | Fe3+ |
| 开始沉淀时的 pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的 pH | 13.9 | 11.1 | 3.2 |
流程中,滤渣Ⅱ中含_______(填化学式)。加入 H2C2O4 时应避免过量,原因是_______。 [已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9]
(3)利用间接酸碱滴定法可测定 Ba2+的含量,实验分两步进行。已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取 xmL 一定浓度的 Na2CrO4 溶液与锥形瓶中,加入酸碱指示剂,用 b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为 V0 mL。
步骤Ⅱ:移取 y mLBaCl2 溶液于锥形瓶中,加入 x mL 与步骤Ⅰ相同浓度的 Na2CrO4 溶液,待 Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为 V1 mL。滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的_______(填“上方”或“下方”)。BaCl2 溶液的浓度为___________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将_______(填“偏大”或“偏小”或“无影响”)。
-
毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如下:
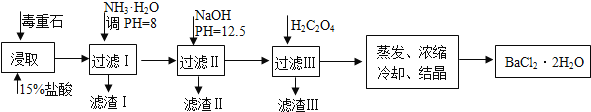
完成下列填空:
(1)毒重石用盐酸浸取前需充分研磨,目的是____________________。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的____________________________。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
(2)加入NH3•H2O调节pH=8可除去_______(填离子符号),滤渣Ⅱ 中含__________(填化学式)。加入H2C2O4时应避免过量,原因是_________________________。
已知:Ksp(BaC2O4)=1.6×10﹣7,Ksp(CaC2O4)=2.3×10﹣9
| Ca2+ | Mg2+ | Fe3+ |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
-
毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
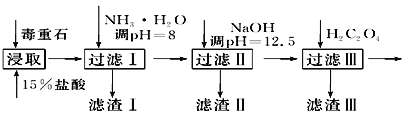
(1)毒重石用盐酸浸取前需充分研磨,目的是_______________________________________;实验室用37%的盐酸配制15%的盐酸,除量筒外还需使用下列仪器中的________。
a.烧杯 b.一定容积的容量瓶 c.玻璃棒 d.滴定管
(2)查阅有关资料获得沉淀各种杂质离子的pH见下表:
| 沉淀杂质离子 | Ca2+ | Mg2+ | Fe3+ |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
加入NH3·H2O调节pH=8可除去______(填离子符号);滤渣Ⅱ中含__________(填化学式)。加入H2C2O4时应避免过量,原因是_____________________(已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9)。
(3)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。已知:2CrO +2H+===Cr2O
+2H+===Cr2O +H2O Ba2++CrO
+H2O Ba2++CrO ===BaCrO4↓
===BaCrO4↓
步骤Ⅰ.准确移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入几滴酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0 mL。
步骤Ⅱ.准确移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的________(选填“上方”或“下方”)。BaCl2溶液的浓度为________________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则所测得Ba2+浓度测量值将________(选填“偏大”或“偏小”)。














