-
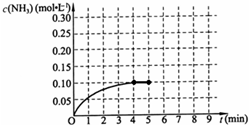
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)⇌2NH3(g)△H<0;反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
(1)根据右图,计算从反应开始到平衡时,平均反应速率v(NH3)为______.
(2)该反应到平衡时H2的转化率是______.
(3)若容器容积不变,下列措施可增加NH3产率的是______.
A.升高温度 B.将NH3(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入0.2molN2和0.6molH2
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡向______移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数______(填“增大”、“减少”或“不变”).
-
在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
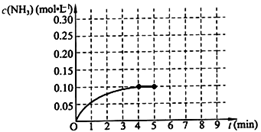
根据图,计算从反应开始到平衡时,平均反应速率v(NH3)=________。
⑵下列描述中能说明上述反应已达平衡的是________。
A.3v正(H2)=2v逆(NH3)
B.容器中气体的平均相对分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
⑶ 第5分钟末,保持恒温恒压,若继续通入0.2mol的N2和0.6mol的H2,平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
-
在一容积为2 L的密闭容器内加入0.2 mol 的N2和0.6 mol 的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0,反应中NH3的物质的量浓度的变化的情况如右图:
2NH3(g) △H<0,反应中NH3的物质的量浓度的变化的情况如右图:

(1)根据右图,计算从反应开始到平衡时,平均反应速率v(NH3)为_________________。
(2)该反应的化学平衡常数表达式K=___________________。
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________。
a. 0.20 mol/L b. 0.12 mol/L c. 0.10 mol/L d. 0.08 mol/L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡_________________________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数________________(填“增大”、“减小”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。___________________
-
(10分)在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
⑴ 根据下图,计算从反应开始到平衡时,平均反应速率v(NH3)=______________________________
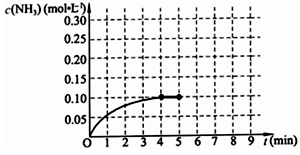
⑵ 该反应450℃的平衡常数________500℃时的平衡常数(填“>”、“<”或“=”)。
⑶ 下列描述中能说明上述反应已达平衡的是___________。
A.3v正(H2)=2v逆(NH3)
B.容器中气体的平均相对分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
⑷ 第5分钟末,保持恒温恒压,若继续通入0.2mol的N2和0.6mol的H2,平衡_______________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
⑸ 第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3浓度约为0.25mol/L),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
-
(10分)在一固定容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) △H<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
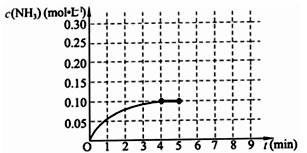
⑴ 根据上图,计算从反应开始到平衡时,平均反应速率v(NH3)=_________________。
⑵ 该反应450℃的平衡常数________500℃时的平衡常数(填“>”、“<”或“=”)。
⑶ 下列描述中能说明上述反应已达平衡的是___________。
A.3v正(H2)=2v逆(NH3)
B.容器中气体的平均相对分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
⑷ 第5分钟末,保持恒温恒压,若继续通入0.2mol的N2和0.6mol的H2,平衡_______________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
⑸ 第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3浓度约为0.25mol/L),请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
-
(10分)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g) △H <0
2NH3(g) △H <0
(1)该反应450℃的平衡常数________500℃时的平衡常数(填“>”、“<”或“=”);
(2)下列描述中能说明上述反应已达平衡的是________
a.3v正(H2)=2v逆(NH3) b.容器中气体的平均相对分子量不随时间而变化
c.容器中气体的密度不随时间而变化 d.容器中气体的分子总数不随时间而变化
(3)上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol
计算从反应开始到平衡时,平均反应速率v(N2)为________mol/(L·min)
(4)保持其他条件不变,若初始投入量为a molN2、b molH2 、c molNH3,也可得到与上述相同的平衡,则a、b、c需满足关系式:________ ________ ;
(5)第5分钟末,保持其它条件不变, 若继续通入0.2 mol的N2和0.6 mol的H2,
则平衡________移动(填“向正反应方向”“向逆反应方向”或“不”)。
-
(12分)在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g)△H<0,反应中NH3的浓度变化如下图:
2NH3(g)△H<0,反应中NH3的浓度变化如下图:
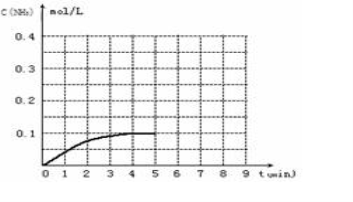
(1)根据上图,4min~5min之间,反应处于_________状态;(填“平衡”或“非平衡”)。
计算0~4min内,平均反应速率υ(NH3)= 。
(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,反应达到新平衡后,则NH3的物质的量浓度不可能为 。
A.0.2mol·L-1 B.0.12mol·L-1 C.0.10mol·L-1 D.0.08mol·L-1
(3)反应达到平衡后,第5分钟末,保持其它条件不变,把容器的体积缩小为原来的一半,则平衡________________移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数________(填“增大”、“减小”或“不变”)。
(4)在第5分钟末,将容器体积缩小为原来的一半后,若在第8分钟末达到新的平衡时(此时NH3的浓度约为0.25mol·L-1)。请在上图中画出第5分钟末到平衡时NH3浓度的变化曲线。
-
(9分)在一容积为2 L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,反应中NH3的物质的量浓度的变化情况如下图:
2NH3(g) ΔH<0,反应中NH3的物质的量浓度的变化情况如下图:
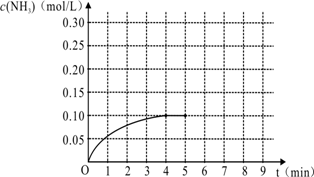
请回答下列问题:
(1)该反应的化学平衡常数K表达式为______________________;
升高温度K值________(填“变大”、“变小”或“不变”)
(2)根据上图,计算从反应开始到平衡时,平均反应速率v(H2)为____________。
(3)判断该反应达到平衡状态的标志是________(填字母);
a.N2和NH3浓度相等 b.NH3百分含量保持不变
c.容器中气体的压强不变 d.NH3的生成速率与H2的消耗速率相等
e.容器中混合气体的密度保持不变
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为_______________。
a. 0.20 mol/L b. 0.12 mol/L c. 0.10 mol/L d.0.08 mol/L
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L),请在上图中画出第5分钟末达到此平衡时NH3浓度的变化曲线。
-
在一容积为2L的密闭容器中,加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:
N2(g)+3H2(g) 2NH3(g)△HPO反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题;
2NH3(g)△HPO反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题;

(1)根据如图,计算从反应开始到平衡时,平均反应速率v(NH3)为______.
(2)该反应的化学平衡常数表达式K______.
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为______.(填序号).
a 0.20mol•L-1 b 0.12mol•L-1 c 0.10mol•L-1 d 0.08mol•L-1
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡______移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数______(填“增大”、“减少”或“不变”).
(6)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡,请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
-
在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)2NH3(g)+Q(Q>0),反应中NH3的物质的量浓度的变化情况如图:
(1)该反应的化学平衡常数表达式为______;
(2)根据上图,计算从反应开始到平衡时,平均反应速率v(H2)为______.
(3)判断该反应达到平衡状态的标志是______(填字母);
a.N2和NH3浓度相等 b.NH3百分含量保持不变
c.容器中气体的压强不变 d.NH3的生成速率与H2的消耗速率相等
e.容器中混合气体的密度保持不变
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为______.
a.0.20mol/L b.0.12mol/L c.0.10mol/L d.0.08mol/L
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol/L),请在上图中画出第5分钟末达到此平衡时NH3浓度的变化曲线______.










