-
(15分)(1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
①写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: 。
②若将(1)中的反应设计成原电池,写出电极反应式。
正极反应 ;负极反应___________________________。
(2)二甲醚(CH3OCH3)是一种重要的清洁燃料,可以通过CH3OH分子间脱水制得:
2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-23.5 J·mol-1。
CH3OCH3(g)+H2O(g) ΔH=-23.5 J·mol-1。
在T1℃,恒容密闭容器中建立上述平衡,体系中各组分浓度随时间变化如图所示。
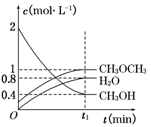
①该条件下反应平衡常数表达式K=_____。在T1℃时,反应的平衡常数为________;
②相同条件下,若改变起始浓度,某时刻各组分浓度依次为c(CH3OH)=0.4 mol·L-1,c(H2O)=0.6 mol·L-1、c(CH3OCH3)=1.2 mol·L-1,此时正、逆反应速率的大小:v(正) v(逆)(填“>”、“<”或“=”)。
-
(1)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。写出FeCl3溶液腐蚀印刷电路铜板的离子方程式___。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤___。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
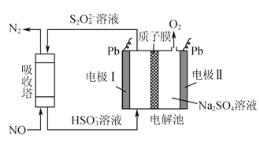
(2)间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示,质子膜允许H+和H2O通过。电极Ⅰ为___极,电极反应式为___,吸收塔中的反应为____,每处理1molNO,可同时得到___gO2。
(3)“重油-氧气-熔融碳酸钠”燃料电池装置如图所示。下列说法错误的是(______)
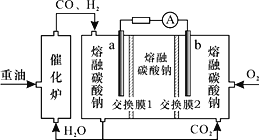
A.O2在b极得电子,最终被还原为CO32-
B.放电过程中,电子由电极a经导线流向电极b
C.该电池工作时,CO32-经“交换膜2”移向b极
D.H2参与的电极反应为H2-2e-+CO32-=H2O+CO2
-
(12分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血
剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图(标出电极材料和电解质溶液),并写出电极反应式。

正极反应 ,
负投反应。
(3)某同学用碳棒、铜棒和稀硫酸为原材料,以及一些必要条件,实现 Cu+H2SO4(稀)=CuSO4+H2↑反应。请在框内画出能够实现这一反应的实验装置图。

(4)另一位同学在做(3)反应实验时,看到碳棒和铜棒
上都有气泡产生,但铜棒没有被腐蚀。请你分析其原因
,
此时的总反应为________。
-
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、
负极,并写出电极反应式。
正极反应: 。
负极反应: 。
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤 。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀 完全时的pH |
| Fe3+ Fe2+ | 1.9 7.0 | 3.2 9.0 |
| Cu2+ | 4.7 | 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
| | |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显。请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。有关反应的化学方程式 ; ;劣质不锈钢腐蚀的实验现象 。
-
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正极、负极,并写出电极反应。
正极反应 ;
负极反应 。
-
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式______.
(2)若将(1)中的反应设计成原电池,请在右边方框内画出原电池的装置图,标出正、负极,并写出电极反应式.
正极反应______负极反应______
(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照下表给出的数据和药品,简述除去CuCl2溶液中Fe3+和Fe2+的实验步骤______
| | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
Fe3+
Fe2+
Cu2+ | 1.9
7.0
4.7 | 3.2
9.0
6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
(4)某科研人员发现劣质不锈钢在酸中腐蚀缓慢,但在某些盐溶液中腐蚀现象明显.请从上表提供的药品中选择两种(水可任选),设计最佳实验,验证劣质不锈钢腐蚀.有关反应的化学方程式______;劣质不锈钢腐蚀的实验现象______.
-
铁及铁的化合物应用广泛,如FeCl3可用做催化剂、印刷电路铜板腐蚀剂和外伤止血剂等.
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式是______.
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图______(标出正、负极材料及电解质溶液),并写出电极反应式.正极反应______,负极反应______.
(3)某科研人员发现劣质不锈钢在某些盐溶液中腐蚀现象明显.请从提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu中选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀.有关反应的化学方程式①______②______.劣质不锈钢腐蚀的实验现象______.
(4)Li-SOCl2电池可用于心脏起搏器.该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2.电池的总反应可表示为:4Li+2SOCl2═4LiCl+S+SO2.该电池正极发生的电极反应为______.
-
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式_____________。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极__________,并写出电极反应式。正极反应__________,负极反应____________。若用此电池向外电路输送0.5mol电子,负极质量_______(填增重或减轻)____克。
-
(11分)铁及铁的化合物应用广泛,如FeCl3可用做催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式是______________________。
(2)若将1中的反应设计成原电池,请画出原电池的装置图__________________(标出正、负极材料及电解质溶液),并写出电极反应式。
正极反应________________,负极反应__________________。
(3)某科研人员发现劣质不锈钢在某些盐溶液中腐蚀现象明显。请从提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu中选择两种水可任选,设计最佳实验,验证劣质不锈钢易被腐蚀。
有关反应的化学方程式①_____________________________
②_____________________________。
劣质不锈钢腐蚀的实验现象_____________________________。
(4)Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=== 4LiCl+S+SO2。该电池正极发生的电极反应为____________________________。
-
铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜版腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式____________________________________。
(2)若将(1)中的反应设计成如图所示原电池,则负极反应式为:_____________________,正极反应式:________________________;电子从_______流向________(填“Cu”或“石墨”)。

(3)腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol·L-1,请参照下表给出的数据和药品,完成除去CuCl2溶液中Fe3+和Fe2+的实验步骤。
①通入足量_________将Fe2+氧化为Fe3+。
②加入_________调节溶液的pH至3.2~4.7,使______________ 完全沉淀然后过滤。
| 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH |
| Fe3+ Fe2+ Cu2+ | 1.9 7.0 4.7 | 3.2 9.0 6.7 |
| 提供的药品:Cl2 浓H2SO4 NaOH溶液 CuO Cu |
CH3OCH3(g)+H2O(g) ΔH=-23.5 J·mol-1。



