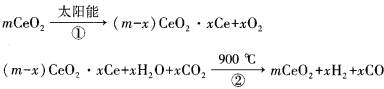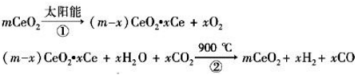-
(18分)能源的开发和利用是当前科学研究的重要课题。
(1)利用二氧化铈(CeO2)在太阳能作用下前实现如下变废为宝的过程:
mCeO2 (m-x)CeO2
(m-x)CeO2 xCe+xO2
xCe+xO2
(m-x)CeO2 xCe+xH2O+xCO2
xCe+xH2O+xCO2 mCeO2+xH2+xCO
mCeO2+xH2+xCO
上述过程的总反应是 ,该反应将太阳能转化为 。
(2)CO、O2和KOH溶液构成的燃料电池的负极电极反应式为 。该电池反应可获得K2CO3溶液,某温度下0.5mol L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O
L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O HCO3-+OH-的平衡常熟Kh= 。
HCO3-+OH-的平衡常熟Kh= 。
(3)氯碱工业是高耗能产业,下列将电解池与燃料电池相组合的工艺可以节能30%以上。

①电解过程中发生反应的离子方程式是 ,阴极附近溶液PH (填“不变”、“升高”或“下降”)。
②如果粗盐中SO42-含量较高,精制过程需添加钡试剂除去SO42-,该钡试剂可选用下列试剂中的 。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
现代工艺中更多使用BaCO3除SO42-,请写出发生反应的离子方程式 。
③图中氢氧化钠溶液的质量分数a% b%(填“>”、‘‘=”或“<”),,燃料电池中负极上发生的电极反应为 。
-
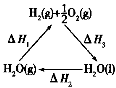
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
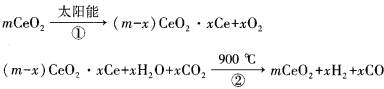
下列说法不正确的是
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.如图中△H1=△H2+△H3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH−−2e−
 +2H2O
+2H2O
-
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
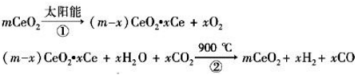
下列说法不正确的是
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.右图中△H1=△H2+△H3 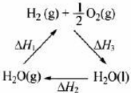
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH――2e-═CO32-+2H2O
-
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O 、CO2转变为H2、CO。其过程如下:
、CO2转变为H2、CO。其过程如下:

下列说法不正确的是( )
A.该过程中CeO2为H2O、CO2转变为H2、CO的催化剂
B.该过程实现了太阳能向化学能的转化
C.1molCeO2参加反应,共生成2x mol的气体
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO32-+2H2O
-
研究含硫物质的循环,是能源开发和利用的重要途径之一。
(1)研究人员利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
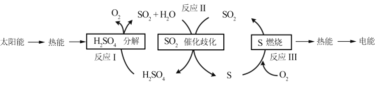
①反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ•mol -1
反应Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJ•mol -1
反应Ⅱ的热化学方程式为________。
②对于反应Ⅱ,将投料比(n(SO2):n(H2O))为 3:2 的混合气体充入恒容的密闭容器中, 在不同压强下,H2SO4 在平衡体系中物质的量分数随温度的变化关系如下图所示。下列说法不正确的是___
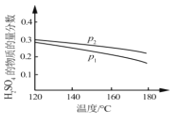
A.p2>p1,反应Ⅱ的ΔS < 0
B.使用合适催化剂可以提高 H2SO4 在平衡体系中物质的量分数
C.其他条件相同时,投料比(n(SO2):n(H2O))改变为 2:1,可提高 SO2 的平衡转化率
D.当容器内气体的密度不变时,可判断反应达到平衡状态
E.温度升高,有利于反应速率加快,SO2 的平衡转化率提高,K 值变小
(2)“硫碘循环”法是分解水制氢气的研究热点,涉及下列三个反应:
反应A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应B:2HI(g) ⇌ H2(g) + I2(g)
反应C:2H2SO4(g) ⇌ 2H2O(g) + 2SO2(g) + O2(g)
①某温度下将 1mol HI 充入密闭容器中发生反应B,达到第 1 次平衡后,用选择性膜完全分离出 H2,达到第 2 次平衡后再次分离H2,重复多次,平衡时 n(HI)如下表:
| 达到平衡的次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 | 第 5 次 | …… |
| n(HI)/mol | 0.78 | 0.67 | 0.60 | 0.55 | 0.51 | …… |
归纳出分离 H2 的次数对 HI 转化率的影响________。第 2 次平衡时 I2 的物质的量为 n(I2)=_____mol;
②反应 A 发生时,溶液中同时存在以下化学平衡: I2(aq) + I‑(aq)⇌ (aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中
(aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中 的物质的量 n( I3- )随反应时间 t 变化的曲线图____。
的物质的量 n( I3- )随反应时间 t 变化的曲线图____。

-
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变成H2、CO。其过程如下:
mCeO2 (m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2
(m-x)CeO2·xCe+xO2(m-x)CeO2·xCe+xH2O+ xCO2 mCeO2+ xH2+ xCO
mCeO2+ xH2+ xCO
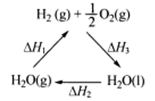
下列说法不正确的是
A.该过程中CeO2没有消耗
B.该过程实现了太阳能向化学能的转化
C.右图中△H1=△H2+△H3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH——2e—=CO32-+2H2O
-
某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
mCeO2 (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2 mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是( )
A.该过程中CeO2没有消耗

B.该过程实现了太阳能向化学能的转化
C.图中ΔH1=ΔH2+ΔH3
D.以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO32-+2H2O
-
“碳捕捉和储存(CCS)技术”是指通过碳捕捉技术,将工业和有关能源产业所产生的二氧化碳分离出来再利用。当前,二氧化碳及其产品的开发、应用是很多科学家致力研究的课题。下列有关说法不正确的是 ( )
A.对捕捉到的二氧化碳进行净化,然后用于制造干冰
B.以捕捉到的二氧化碳为原料,用来制备甲醇等产品
C.用捕捉到的二氧化碳与海藻发生光合作用,可提高海藻产量
D.人类应将大气中的二氧化碳全部捕捉,以防产生温室效应
-
“碳捕捉和储存(CCS)”技术是指通过碳捕捉技术,将工业和有关能源产业所产生的二氧化碳分离出来再利用。当前,二氧化碳及其产品的开发、应用是很多科学家致力研究的课题。下列有关说法不正确的是( )
A.人类应将大气中的二氧化碳全部捕捉,以防产生温室效应
B.对捕捉到的二氧化碳进行净化,然后用于制造干冰
C.以捕捉到的二氧化碳为原料,用来制备甲醇等产品
D.用捕捉到的二氧化碳与海藻发生光合作用,可提高海藻产量
-
二氧化碳的回收利用是环保和能源领域研究的热点课题。
(1)新的研究表明,利用太阳能可以将CO2分解制取炭黑,其原理如右图所示。该过程的能量转化形式为______,在整个过程中,FeO的作用是_________。
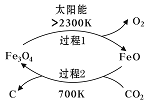
已知:
①2Fe2O4(s)=6FeO(s)+O2(g) ΔH=akJ/mol
②C(s)+O2(g)=CO2(g) ΔH=bKJ/mol 则过程2的热化学方程式为________。
(2)一定温度下,在密闭容器中进行反应CO2(g)+CH4(g) 2CO(g)+2H2(g) ΔH>0,下列说法正确的是________。
2CO(g)+2H2(g) ΔH>0,下列说法正确的是________。
A.当混合气体的平均相对分子质量不变时,反应达到平衡状态
B.升高温度,加快反应速率,CO2的转化率降低
C.增大CO2的浓度,平衡向正反应方向移动,平衡常数增大
D.平衡时CO、H2的体积分数不一定相等
(3)在2L恒容密闭容器中充入2molCO2和nmolH2,在一定条件下发生反应CO2(g)+3H2(g) CH3COOH(g)+H2O(g),CO2的转化率与温度、投料比
CH3COOH(g)+H2O(g),CO2的转化率与温度、投料比 的关系如右图所示。
的关系如右图所示。

①若从反应开始到A点需要10s,则V(H2)= _____。
②该反应的平衡常数表达式为______,若X1=3,则B点的K=___________。
③根据图像判断X1 ____X2(填“>”、“<”或“=”,下同),平衡常数KA ___KB。
④若在500K时,按X1投料,在恒压下进行,达到平衡状态,此时CO2的转化率______75%(填“>”、“<”或“=”)
(4)美国伊利诺大学芝加哥分校(UIC)的研究团队设计出一种突破性的新太阳能电池,能把大气中的二氧化碳转换成碳氢化合物(hydrocarbon)燃料,解决了现代社会的两大挑战:“减少大气的碳含量”以及“有效率地制造高密度能源”。右图是通过CO2和H2O作用制备CH3OH的原理示意图。
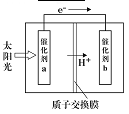
①a电极的名称_________,电极产物___________。
②b电极的电极反应为_________。
(m-x)CeO2
xCe+xO2
xCe+xH2O+xCO2
mCeO2+xH2+xCO
L-1 K2CO3溶液的pH=12,若忽略CO32-的第二级水解,则CO32- +H2O
HCO3-+OH-的平衡常熟Kh= 。