-
综合利用CO2、CO对构建低碳社会有重要意义。
(1) H2 和CO合成甲醇反应为:CO(g)+2H2(g) CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为_______;10min内用H2表示的化学反应速率为_______;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有_______(填一种合理的措施)。
CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为_______;10min内用H2表示的化学反应速率为_______;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有_______(填一种合理的措施)。
(2) 二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g) +3H2(g)  CH3OH(g) +H2O(g)+Q。
CH3OH(g) +H2O(g)+Q。
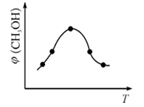
①该反应的平衡常数表达式为K=________。②在恒容密闭容器中使CO2和H2(物质的量之比为1∶3)发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如下图所示,则Q_________0(填“大于”或“小于”)
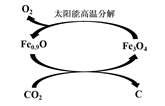
(3) 如下图所示,利用缺铁氧化物[如Fe0.9O]可实现CO2的综合利用。请说明该转化的2个优点_____________。若用1 mol缺铁氧化物[Fe0.9O]与足量CO2完全反应可生成________mol C(碳)。
-
研究CO2、CO的利用对促进低碳社会的构建具有重要意义,CO2、CO都可用于合成甲醇。
(1)CO2用于合成甲醇的热化学方程式为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H
CH3OH(g)+H2O(g) △H
①该反应的平衡常数表达式为K= 。
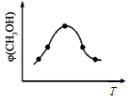
②取一定体积CO2和H2的混合气体(物质的量之比为1∶3),加入恒容密闭容器中发生上述反应,反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图所示,则该反应的ΔH 0(填“>”、“<”或“=”)。
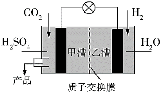
③科学家现正研发的以实现CO2转化为甲醇在常温常压下进行的装置如图所示,写出甲槽的电极反应式______________。
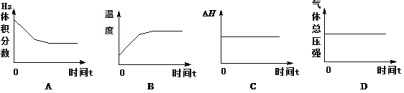
(2)CO用于合成甲醇的热化学方程式为:CO(g)+2H2(g) CH3OH(g) △H,在压强为0.1 MPa、温度为300 ℃条件下,将a mol CO与2a mol H2的混合气体在催化剂作用下发生下面反应2生成甲醇,下列图像正确且说明可逆反应达到平衡状态的是 。(填序号)
CH3OH(g) △H,在压强为0.1 MPa、温度为300 ℃条件下,将a mol CO与2a mol H2的混合气体在催化剂作用下发生下面反应2生成甲醇,下列图像正确且说明可逆反应达到平衡状态的是 。(填序号)
(3)以CH4和H2O为原料,也可通过下列反应1和反应2来制备甲醇。
反应1:CH4(g)+ H2O(g) CO(g)+ 3H2(g) ΔH= + 206.0 kJ·mol-1
CO(g)+ 3H2(g) ΔH= + 206.0 kJ·mol-1
反应2:CO(g)+ 2H2(g) CH3OH(g) ΔH=-129.0 kJ·mol-1
CH3OH(g) ΔH=-129.0 kJ·mol-1
①CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为__________________。
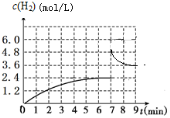
②已知:在700 ℃,1 MPa时,1 mol CH4与1 mol H2O在1 L密闭容器中发生反应1,6min达到平衡(如图),此时CH4的转化率为________________。根据右图分析,由第一次平衡到第二次平衡,平衡向__________方向移动(填“正反应”或“逆反应”),采取的措施可能是_____________________。
-
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO2和H2可直接合成甲醇,向一密闭容器中充入CO2和H2,发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH
CH3OH(g)+H2O(g) ΔH
①保持温度、体积一定,能说明上述反应达到平衡状态的是____。
A.容器内压强不变 B.3v正(CH3OH)= v正(H2)
C.容器内气体的密度不变 D.CO2与H2O的物质的量之比保持不变
②测得不同温度时CH3OH的物质的量随时间的变化如图1所示,则ΔH____0(填“>”或“<”)。

(2)工业生产中需对空气中的CO进行监测。
①PdCl2溶液可以检验空气中少量的CO。当空气中含CO时,溶液中会产生黑色的Pd沉淀。若反应中有0.02 mol电子转移,则生成Pd沉淀的质量为______。
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其模型如图2所示。这种传感器利用了原电池原理,则该电池的负极反应式为______。
(3)某催化剂可将CO2和CH4转化成乙酸。催化剂的催化效率和乙酸的生成速率随温度的变化关系如图3所示。乙酸的生成速率主要取决于温度影响的范围是______。
(4)常温下,将一定量的CO2通入石灰乳中充分反应,达平衡后,溶液的pH为11,则c( )=____。(已知:Ksp[Ca(OH)2]=5.6×10−6,Ksp(CaCO3) =2.8×10−9)
)=____。(已知:Ksp[Ca(OH)2]=5.6×10−6,Ksp(CaCO3) =2.8×10−9)
(5)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。图4是通过光电转化原理以廉价原料制备新产品的示意图。催化剂a、b之间连接导线上电子流动方向是____(填“a→b”或“b→a”)。
-
研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)在一定条件下将CO2和H2转化为甲醇蒸气和水蒸气的相关反应有:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=+41kJ/mol
CH3OH(g)+H2O(g) △H1=+41kJ/mol
CO(g)+2H2(g) CH3OH(g) △H2=-90kJ/mol
CH3OH(g) △H2=-90kJ/mol
则由CO2和H2转化为甲醇蒸气和水蒸气的热化学方程式为_________________。
(2)在一定温度下,向2L固定容积的密闭容器中通入2molCO2、3molH2,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H3<0。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H3<0。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
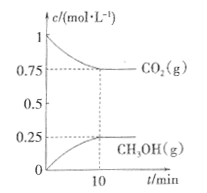
①能说明该反应已达平衡状态的是________。
A.CO2的体积分数在混合气体中保持不变
B.体系中n(CO2)/n(H2)=1:1,且保持不变
C.混合气体的密度不随时间变化
D.单位时间内有n molH-H键断裂,同时又n mol O-H键生成
②下列措施能使n(CH3OH)/n(CO2)增大的是_________。
A.升高温度 B.恒温恒容充入He(g)
C.使用高效催化剂 D.恒温恒容下,再充入2molCO2、3molH2
③计算该温度下此反应的平衡常数K=_____(L/mol)2;若使K的值变为1,则应采取的措施是_______。
A.增大压强 B.恒压加入一定量H2 C.降低温度 D.升高温度
(3)捕捉CO2可以利用Na2CO3溶液。用100mL 0.1mol/LNa2CO3溶液完全捕捉224mL(已换算为标准状况,溶液体积变化忽略不计)CO2气体,所得溶液中:
①c(HCO3-)+c(CO32-)+c(H2CO3)=_________mol/L(填数字)。
②c(HCO3-)+2c(CO32-)=____________(用相关离子浓度表示)。
-
固定利用CO2对减少温室气体排放意义重大。CO2加氢合成甲醇是CO2综合利用的一条新途径。CO2和H2在催化剂作用下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH<0
CH3OH(g)+H2O(g) ΔH<0
(1)测得甲醇的理论产率与反应温度、压强的关系如图所示。

①下列措施能使CO2的转化率提高的是____(填序号)。
A.增大压强 B.升高温度 C.增大H2投料比 D.用更高效的催化剂
②在220℃、5.0MPa时,CO2、H2的转化率之比为___________。
③将温度从220℃降低至160℃,压强从5.0MPa减小至3.0MPa,化学反应速率将_____(填“增大”“减小”或“不变”下同),CO2的转化率将_____。
④200℃时,将0.100 mol CO2和0.275 mol H2充入1 L密闭容器中,在催化剂作用下反应达到平衡。若CO2的转化率为25%,,则此温度下该反应的平衡常数表达式K=_____________(只用数字填,不必计算出结果)。
(2)若H2(g)和CH3OH(l)的燃烧热分别为-285.8kJ·mol﹣1和-726.5kJ·mol﹣1,则由CO2和H2生成液态甲醇和液态水的热化学方程式为________________________________。
(3)甲醇电解法制氢气比电解水法制氢气的氢的利用率更高、电解电压更低。电解装置如图。
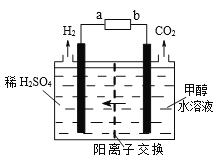
电源的正极为_____(填序号a或b)。其中阳极的电极反应式为_________________;标况下,每消耗1mol甲醇则生成H2的体积为____。
-
(14分)甲醇是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
① CO(g) + 2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
② CO2(g) + 3H2(g) CH3OH(g)+ H2O(g) △H2
CH3OH(g)+ H2O(g) △H2
③ CO2(g) + H2(g) CO(g) + H2O(g) △H3
CO(g) + H2O(g) △H3
回答下列问题:
(1)已知
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
则△H1= kJ.mol-1
(2)图1中能正确表现反应①的平衡常数K随温度变化关系的曲线为 (填曲线标记字母),判断理由是 。
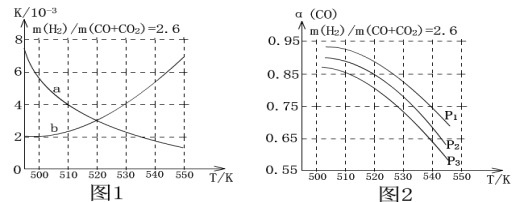
(3)合成气的组成n(H2)/n(CO+CO2)=2.60时体系中的CO平衡转化率(α)与温度和压强的关系如图2所示。α(CO)值随温度升高而 (填“增大”或“减小”)原因是 。
图2中的压强由大到小为 ,判断理由是 。
-
甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
① CO(g)+2H2(g) CH3OH(g) ΔH1 =-99kJ·mol-1
CH3OH(g) ΔH1 =-99kJ·mol-1
② CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③ CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)CO2的电子式是________________。
(2)ΔH3=______kJ·mol-1,②反应正向的熵变ΔS______0(填“>”“<”或“=”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图。
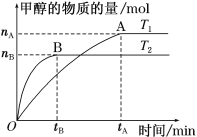
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=_____ mol·L-1·min-1。
②图示的温度T1______T2(填写“>”、“<”或“=”)
(4)T1温度时,将2 mol CO2和6 mol H2充入2 L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,此时容器内的压强与起始压强之比为________;反应②在该温度达到平衡时,其平衡常数的数值为_______。
(5)若反应②在原电池条件下实现,请写出酸性条件下惰性电极上由CO2生成CH3OH的电极反应式:____________________,该电极为原电池的_______极。
-
甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
① CO(g)+2H2(g) CH3OH(g) ΔH1 =-99kJ·mol-1
CH3OH(g) ΔH1 =-99kJ·mol-1
② CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-58 kJ·mol-1
③ CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
(1)CO2的电子式是________________。
(2)ΔH3=______kJ·mol-1,②反应正向的熵变ΔS______0(填“>”“<”或“=”)。
(3)在容积为2 L的密闭容器中,充入一定量CO2和H2合成甲醇(上述②反应),在其他条件不变时,温度T1、T2对反应的影响图像如图。
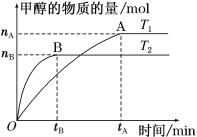
①温度为T1时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)=_____ mol·L-1·min-1。
②图示的温度T1______T2(填写“>”、“<”或“=”)
(4)T1温度时,将2 mol CO2和6 mol H2充入2 L密闭容器中,充分反应(上述②反应)达到平衡后,若CO2转化率为50%,此时容器内的压强与起始压强之比为________;反应②在该温度达到平衡时,其平衡常数的数值为_______。
(5)若反应②在原电池条件下实现,请写出酸性条件下惰性电极上由CO2生成CH3OH的电极反应式:____________________,该电极为原电池的_______极。
-
甲醇可采用多种方法制备,其用途广泛,是重要的化工原料。
Ⅰ.利用合成气(CO、CO2、H2)在催化剂作用下合成甲醇,发生反应如下:
①CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
②CO2(g)+3H2(g) CH3OH(g) + H2O(g)
CH3OH(g) + H2O(g)
(1)反应①过程中能量变化如下图所示,下列说法正确的是______________(填选项标号)。
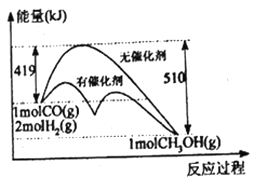
A.①反应的△H=逆反应活化能-正反应活化能
B.把1molCO(g)和2molH2(g)充入密闭容器中充分反应,达平衡时放出的热量为91kJ
C.从图中信息可知加入催化剂能改变反应历程和热效应
D.相同条件下,CO(g)和H2(g)反应生成1mol液态CH3OH放出的热量大于91kJ
(2) 现利用①和②两个反应合成CH3OH, 已知CO可使反应的催化剂寿命下降。
若氢碳比表示为f= [(n(H2)-n(CO2)]/[(n(CO)-n(CO2)],则理论上f=______________时,原料气的利用率最高。但生产中往往采用略高于该值的氢碳比,理由是:______________________________。
Ⅱ.甲醇可用于制取甲酸甲酯,其反应方程式为:CH3OH(g)+CO(g) HCOOCH3(g) △H<0。科研人员的部分研究结果如下:
HCOOCH3(g) △H<0。科研人员的部分研究结果如下:
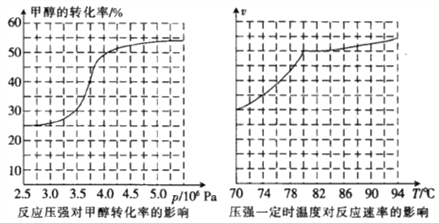
(3)从反应压强对甲醇转化率的影响“效率”图和生产成本角度分析,工业制取甲酸甲酯应选择的最佳压强是______________________(填“3.5×106 Pa”“4.0×106 Pa”或“5.0×106 Pa”)。
(4)实际工业生产中采用的温度是80℃,其理由是_______________________________________。
Ⅲ.甲醇还可以用于合成二甲醚,发生的反应为2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
己知该反应在某温度下的平衡常数为900,此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol/L) | 1.25 | 0.9 | 0.9 |
(5)比较此时正、逆反应速率的大小: v正___________v逆 (填“>“<”或“=”)。
(6) 若加入CH3OH后,经6min反应达到平衡,则该时间内平均反应速率v (CH3OH) =___________mol/ (L·min)。
-
甲醇是重要的化工原料,又可作为燃料。工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2 (g) CH3OH(g) △H1;
CH3OH(g) △H1;
②CO2 (g)+3H2 (g) CH3OH(g)+H2O(g) △H=-58kJ/mol;
CH3OH(g)+H2O(g) △H=-58kJ/mol;
③CO2 (g)+H2(g) CO(g)+H2O(g) △H==+41k J/ mol。
CO(g)+H2O(g) △H==+41k J/ mol。
回答下列问题:
(1)已知反应①中相关的化学键键能数据如下表:
| 化学键 | H—H | C-O | C≡O | H-O | C—H |
| E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | x |
则x=___________。
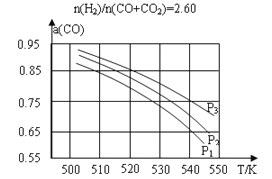
(2)合成气组成n(H2)/n(CO+ CO2)=2.60时,体系中的CO平衡转化率(α)与温度和压强的关系如图甲所示。α(CO)值随温度升高而___________(填“增大”或“减小”),其原因是_____;图中的压强由大到小为___________,其判断理由是_____________。
(3)若将1mol CO2和2molH2充入容积为2L的恒容密闭容器中,在两种不同温度下发生反应②。测得CH3OH的物质的量随时间的变化如图所示。

①曲线I、Ⅱ对应的平衡常数大小关系为K1___________KⅡ(填“>”“=”或“<”)。
②一定温度下,下列能判断该反应达到化学平衡状态的是___________(填序号)。
a.容器中压强不变 b.甲醇和水蒸气的体积比保持不变
c.v正(H2)=3v逆(CH3OH) d.2个C=0断裂的同时有6个H-H断裂
③若5min后反应达到平衡状态,H2的转化率为90%,则用CO2表示的平均反应速率为____,该温度下的平衡常数为___________;若容器容积不变,下列措施可增加甲醇产率的是___________。(填序号)。
a.缩小反应容器的容积 b.使用合适的催化剂
c.充入He d.按原比例再充入CO2和H2
CH3OH(g)(正反应是放热反应)。在恒温,体积为2L的密闭容器中分别充入1.2mol CO和1mol H2,10min后达到平衡,测得含有0.4mol CH3OH(g)。则达到平衡时CO的浓度为_______;10min内用H2表示的化学反应速率为_______;若要加快CH3OH的生成速率并提高CO的转化率,可采取的措施有_______(填一种合理的措施)。

CH3OH(g) +H2O(g)+Q。















