-
硫酸镍晶体(NiSO4•7H2O)可用于电镀工业,可用含镍废催化剂为原料来制备。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al、Fe的单质及其他不溶杂质(不溶于酸碱)。某小组通过查阅资料,设计了如下图所示的制备流程:
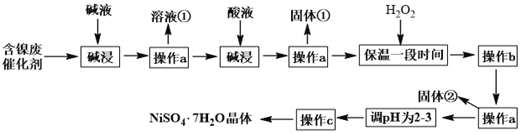
已知: Ksp[Fe(OH)3]=4.0×10-38 ,Ksp[Ni(OH)2]=1.2×10-15
(1)“碱浸”过程中发生反应的离子方程式是_______________________________。
(2)操作a所用到的玻璃仪器有烧杯、________、________;操作c的名称为____________、____________、过滤、洗涤。
(3)固体①是______________;加H2O2的目的是(用离子方程式表示)_____________。
(4)调pH为2-3时所加的酸是________。
(5)操作b为调节溶液的pH,若经过操作b后溶液中c(Ni2+)=2mol·L-1,当铁离子恰好完全沉淀溶液中c(Fe3+)=1.0×10-5mol·L-1时,溶液中是否有Ni(OH)2沉淀生成?________(填“是”或“否”)。
(6)NiSO4•7H2O可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在放电过程中总反应的化学方程式是NiOOH+MH=Ni(OH)2+M,则NiMH电池充电过程中,阳极的电极反应式为_______。
-
硫酸镍晶体(NiSO4•7H2O)可用于电镀工业,可用含镍废催化剂为原料来制备。已知某化工厂的含镍废催化剂主要含有Ni,还含有Al、Fe的单质及其他不溶杂质(不溶于酸碱)。某小组通过查阅资料,设计了如下图所示的制备流程:
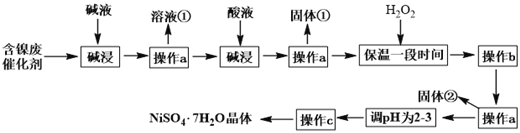
已知: Ksp[Fe(OH)3]=4.0×10-38 ,Ksp[Ni(OH)2]=1.2×10-15
(1)“碱浸”过程中发生反应的离子方程式是_______________________________。
(2)操作a所用到的玻璃仪器有烧杯、________、________;操作c的名称为____________、____________、过滤、洗涤。
(3)固体①是______________;加H2O2的目的是(用离子方程式表示)_____________。
(4)调pH为2-3时所加的酸是________。
(5)操作b为调节溶液的pH,若经过操作b后溶液中c(Ni2+)=2mol·L-1,当铁离子恰好完全沉淀溶液中c(Fe3+)=1.0×10-5mol·L-1时,溶液中是否有Ni(OH)2沉淀生成?________(填“是”或“否”)。
(6)NiSO4•7H2O可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在放电过程中总反应的化学方程式是NiOOH+MH=Ni(OH)2+M,则NiMH电池充电过程中,阳极的电极反应式为_______。
-
硫酸镍(NiSO4)是一种重要的化工原料,广泛应用于电镀、医药、印染等工业。以含镍废催化剂(主要含Ni及少量的Al、Al2O3、Fe和其它不溶于酸、碱的杂质)为原料生产NiSO4·7H2O晶体的两种工艺流程如下:
流程一:

流程二:
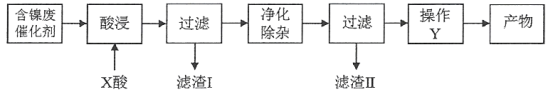
已知:部分金属氢氧化物的Ksp近似值如下表所示:
| 化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
| Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
回答下列问题:
(1)流程一中所用酸A和流程二中所用酸X___________(填“相同”或“不相同”);流程一中滤渣C和流程二中滤渣II___________(填“相同”或“不相同”)。流程二中滤渣I是___________。
(2)流程一中“碱浸”时发生反应的离子方程式为_________________、___________________。
(3)流程二中“净化除杂”包含了两步操作过程:第一步,加入氧化剂H2O2,发生反应的离子方程式是____________________________________________;第二步,调节溶液的pH。
(4)分析比较流程一中操作B和流程二中操作Y后,回答操作Y是___________、___________、过滤、洗涤、干燥,即得产物。
(5)由己知信息列式计算:常温下,Ni2+完全沉淀时的pH值___________。
-
(15分)草酸镍晶体(NiC2O4•2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4•7H2O)主要用于电镀工业。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:

已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0 mol•L-1计算):

②Ksp(CaF2)= 1.46×10-10 Ksp(CaC2O4)= 2.34×10-9
(1)粉碎的目的是 。
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图
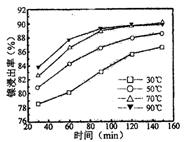
“酸浸”的适宜温度与时间分别为 (填字母)。
A.30℃、30min B.90℃、150min
C.70℃、120min D.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是 。
(4)将“沉镍”工序得到的混合物过滤,所得固体用乙醇洗涤、110℃下烘干,得草酸晶体。
①用乙醇洗涤的目的是 ;
②烘干温度不超过110℃的原因是 。
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”, ,充分反应后过滤,以除去铁、铝元素;
第2步:向所得滤液中加入适量NH4F溶液,充分反应后过滤,得“溶液X”;
第3步: ,充分反应后过滤;
第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
①请补充完整相关实验步骤(可选试剂:H2SO4溶液、NaOH溶液、HNO3溶液、H2O2溶液)
②第2步中加入适量NH4F溶液的作用是 。
-
(15分)草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4·7H2O)主要用于电镀工业。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:

已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
②Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9。

(1)“粉碎”的目的是 。
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如右图。“酸浸”的适宜温度与时间分别为 (填字母)。
a.30℃、30min
b.90℃、150min
c.70℃、120min
d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是 。
(4)将“沉镍”工序得到的混合物过滤,所得固体用乙醇洗涤、110 ℃下烘干,得草酸镍晶体。
①用乙醇洗涤的目的是 。
②烘干温度不超过110℃的原因是 。
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”, ,充分反应后过滤,以除去铁、铝元素;
第2步:向所得滤液中加入适量NH4F溶液,充分反应后过滤,得“溶液X”;
第3步: ,充分反应后过滤;
第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
①请补充完整相关实验步骤(可选试剂:H2SO4溶液、NaOH溶液、HNO3溶液、H2O2溶液)。
②第2步中加入适量NH4F溶液的作用是 。
-
草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4·7H2O)主要用于电镀工业。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:
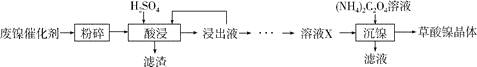
已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |
②Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9。
(1)“粉碎”的目的是____________。
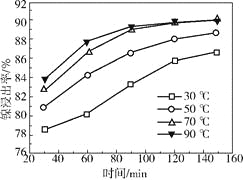
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如右图。“酸浸”的适宜温度与时间分别为_________(填字母)。
a.30℃、30min
b.90℃、150min
c.70℃、120min
d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是___________。
(4)将“沉镍”工序得到的混合物过滤,所得固体用乙醇洗涤、110 ℃下烘干,得草酸镍晶体。
①用乙醇洗涤的目的是_________________。
②烘干温度不超过110℃的原因是_________________。
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”,___,充分反应后过滤,以除去铁、铝元素;
第2步:向所得滤液中加入适量NH4F溶液,充分反应后过滤,得“溶液X”;
第3步:___,充分反应后过滤;
第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
①请补充完整相关实验步骤(可选试剂:H2SO4溶液、NaOH溶液、HNO3溶液、H2O2溶液)。
②第2步中加入适量NH4F溶液的作用是____。
-
某化学研究性学习小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).

部分阳离子以氢氧化物形式完全沉淀时的pH如下:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为______.
(2)“碱浸”过程中发生的离子方程式是______.
(3)“酸浸”时所加入的酸是______(填化学式).酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是______.
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是______.
(5)“调pH为2~3”的目的是______.
(6)产品晶体中有时会混有少量绿矾,其原因可能是______.
-
某化学小组通过查阅资料,设计了如下图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
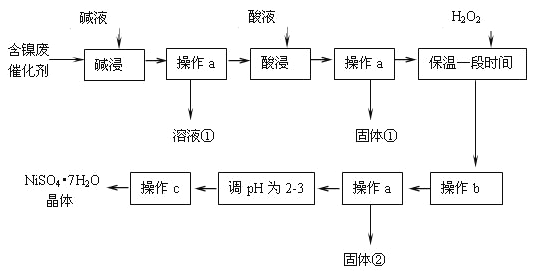
部分阳离子以氢氧化物形式沉淀时的pH如下:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
(1)操作a应选用下列哪种方法或装置:_____
A. B.
B. C.
C.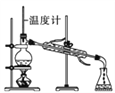 D.
D.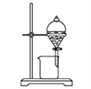
(2)“碱浸”过程中发生反应的离子方程式是________
(3)“酸浸”时所加入的酸是________(填化学式).
(4)加入H2O2时发生反应的离子方程式为________
(5)操作b为调节溶液的pH,你认为pH的调控范围是________
(6)产品晶体中有时会混有少量绿矾(FeSO4•7H2O),其原因可能是____(写出一点即可).
(7)NiSO4•7H2O可用于制备镍氢电池(NiMH),镍氢电池目前已经成为混合动力汽车的一种主要电池类型.NiMH中的M表示储氢金属或合金.该电池在充电过程中总反应的化学方程式是Ni(OH)2+M=NiOOH+MH,则NiMH电池放电过程中,正极的电极反应式为________.
-
NiSO4易溶于水,其水溶液呈酸性,有毒。主要用于电镀工业,也是金属镍离子的来源。NiSO4·6H2O是一种绿色易溶于水的晶体,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如下:
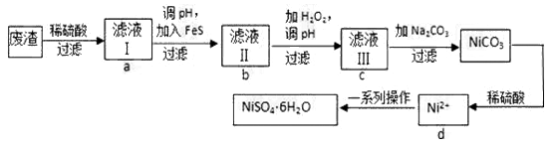
(1)NiSO4水溶液呈酸性原因是_________________________;
(2)向滤液Ⅱ中加入H2O2的离子方程式:_________________________;
(3)调滤液ⅡpH的目的是除去Fe3+,原理是Fe3++3H2O Fe(OH)3+3H+,已知25℃时Ksp[Fe(OH)3]=2.8×10﹣39,则该温度下上述反应的平衡常数K=______,设计实验证明Fe3+已除净_________________;
Fe(OH)3+3H+,已知25℃时Ksp[Fe(OH)3]=2.8×10﹣39,则该温度下上述反应的平衡常数K=______,设计实验证明Fe3+已除净_________________;
(4)滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后得到NiCO3固体,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是______;
(5)从d(NiSO4溶液)经______、______、______洗涤、干燥等操作可得到NiSO4·6H2O晶体;
(6)为了提高产率,分离得到NiSO4·6H2O后剩余液体要循环使用,则应该回流到流程中的______位置(填a、b、c、d)。
-
硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO等)等工业废料生产ZnSO4·7H2O的流程如下:
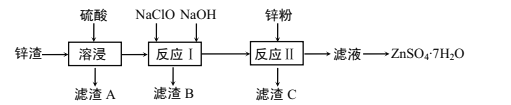
(1)“溶浸”操作中,选用“锌渣”而不选择氧化锌矿粉的原因是______;该操作中不断通入高温水蒸气的目的是________。
(2)“滤渣A”的主要成分是________。
(3)“反应Ⅰ”中,加入NaClO反应的离子方程式为___。
(4)“反应Ⅰ”中,再加入NaOH调节pH约为4.5,则“滤渣B”的主要成分是_____(填化学式)。(Ksp[Zn(OH)2]=3×10-17,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.8×10-39)
(5)“反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是_________。
(6)取28.7gZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
| 温度/℃ | 100 | 250 | 680 | 930 |
| 质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为_________(填字母标号)。
A.ZnO B.Zn3O(SO4)2 C.ZnSO4 D.ZnSO4·H2O













 B.
B. C.
C. D.
D.

