-
已知汽车尾气中的主要污染物为NOx、CO、超细颗粒(PM2.5)等有害物质。目前,已研究出了多种消除汽车尾气污染的方法。
(1)工业上可采用CO和H2合成甲醇,发生反应为(I)CO(g)+2H2(g) CH3OH(g) △H<0 在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是_______。
CH3OH(g) △H<0 在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是_______。
A.正反应速率先增大后减小 B.逆反应速率先增大后减小
C.化学平衡常数K值增大 D.反应物的体积百分含量增大
E.混合气体的密度减小 F.氢气的转化率减小
(2)在汽车上安装三元催化转化器可实现反应:(Ⅱ)2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0 。则该反应在________________(填高温、低温或任何温度)下能自发进行。
N2(g)+2CO2(g) △H<0 。则该反应在________________(填高温、低温或任何温度)下能自发进行。
(3)将NO和CO以一定的流速通过两种不同的催化剂进行反应(Ⅱ),经过相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(脱氮率即NO的转化率),结果如图所示。以下说法正确的是_________
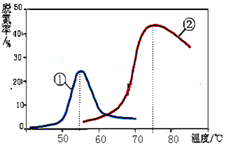
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.曲线①、②最高点表示此时平衡转化率最高
D.两种催化剂分别适宜于55℃和75℃左右脱氮
(4)用焦炭还原NO2的反应为:2NO2(g)+2C(s) N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
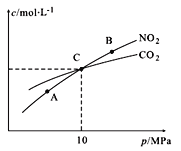
① A、B两点的浓度平衡常数关系:Kc(A)_______Kc(B)(填“<” 或“>”或“=”)。
② A、B、C三点中NO2的转化率最高的是____(填“A”或“B”或“C”)点。
③ 计算C点时该反应的压强平衡常数Kp(C)=______(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
-
经研究发现,含pM2.5的雾霾主要成分有SO2、NOx、CxHy,及可吸入颗粒等.
(1)pM2.5的雾霾中能形成酸雨的物质是_______.
(2)为消除NOx对环境的污染,可利用NH3在一定条件下与NO反应生成无污染的气体.
已知: △H=-900.0 kJ·moL-1
△H=-900.0 kJ·moL-1
 △H=+180.0 kJ·moL-1
△H=+180.0 kJ·moL-1
已知NH3(g)与NO(g)在一定条件下反应,生成无污染气体,请写出转化过程的热化学反应方程式___________________.
(3)对于反应 ,在恒温恒容条件下,向密闭容器中加入等物质的N2和O2.下列方法中可以说明可逆反应已达平衡状态的是____________.
,在恒温恒容条件下,向密闭容器中加入等物质的N2和O2.下列方法中可以说明可逆反应已达平衡状态的是____________.
a.容器内压强不再变化
b.混合气体密度不再变化
c.混合气体的平均相对分子质量不再变化
d.NO的质量分数不再变化
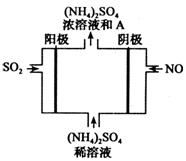
(4)下图电解装置可将雾霾中的SO2、NO转化为(NH4)2SO4,阴极的电极反应式是________,物质A是_________(填名称)
-
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5微米的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样,若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离 子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,试样的pH= 。
(2)为减少SO2的排放,可洗涤含SO2的烟气,下列物质可作洗涤剂的是 (填字母)。
A. Ca(OH)2 B. Na2CO3 C. CaCl2 D. NaHSO3
(3)①已知汽缸中生成NO的反应为N2(g)+O2(g) 2NO(g) ΔH>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
2NO(g) ΔH>0,汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g) 2C(s)+O2(g)。已知该反应的ΔH>0,简述该设想能否实现的依据 。
2C(s)+O2(g)。已知该反应的ΔH>0,简述该设想能否实现的依据 。
-
(10分)某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH约为 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:
2H2(g)+O2(g)=2H2O(g) K1
2C(s)+O2(g)=2CO(g) K2
C(s)+ H2O(g)=CO(g)+ H2(g) K=_______(用含K1、K2的式子表示)。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 。
A.Ca(OH)2 B.Na2CO3 C.CaCl2 D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化为
①已知气缸中生成NO的反应为:N2 (g)+O2(g) 2NO(g) △H
2NO(g) △H 0
0
若1mol空气含0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡,测得NO为8×10-4mol。计算该温度下的平衡常数K= 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO,2CO(g)=2C(s)+O2(g)。已知该反应的△H 0,简述该设想能否实现的依据 。
0,简述该设想能否实现的依据 。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
-
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均 浓度如下表:
浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L | 4x10-6 | 6x10-6 | 2x10-5 | 4x10-5 | 3x10-5 | 2x10-5 |
根据表中数据判断PM2.5的酸碱性为____________,
⑵ ①将煤转化为清洁气体燃料。已知:
H2(g)+1/2O2(g)=H2O(g) H=-241.8KJ/mol
H=-241.8KJ/mol
C(s)+1/2O2(g)=CO(g) H=-110.5KJ/mol
H=-110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式_______________________;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是_________________
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为______________
-
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5 、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH | SO | NO | Cl- |
| 浓度(mol·L-1) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5试样的pH=_____________。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+ O2(g) = H2O(g) ΔH=-241.8 kJ·mol-1
O2(g) = H2O(g) ΔH=-241.8 kJ·mol-1
C(s)+ O2(g) = CO(g) ΔH=-110.5 kJ·mol-1
O2(g) = CO(g) ΔH=-110.5 kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式:______________________________________。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是________。(填字母)
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化
①已知汽缸中生成NO的反应为:N2(g)+O2(g) ⇌2NO(g) ΔH>0。汽车启动后,汽缸温度越高,单位时间内NO排放量越大,原因是___________________。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g) = 2C(s)+O2(g)。已知该反应的ΔH>0,简述该设想能否实现的依据:____________________。
-
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,试样的pH值 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:H2(g)+1/2O2(g)=H2O(g)  H= -241.8KJ/mol
H= -241.8KJ/mol
C(s)+1/2O2(g)=CO(g)  H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式 ;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 ;
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g)
2NO(g)  H>0
H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8×10-4mol.计算该温度下的平衡常数K= ___________;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)已知该反应的 H>0,简述该设想能否实现的依据 。
H>0,简述该设想能否实现的依据 。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
-
重庆市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2. 5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义.请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:

根据表中数据判断PM2.5待测试样的pH约为____________。
(2)为减少SO2的排放,常采取的措施有:将煤转化为清洁气体燃料。
已知:①2H2(g)+O2(g)═2H2O(g)K1 ② 2C(s)+O2(g)═2CO(g)K2
C(s)+H2O(g)=CO(g)+H2(g) K=___________________(用含K1、K2的式子表示)。
(3)汽车尾气净化的主要原理为:2NO(g)+2CO(g) 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
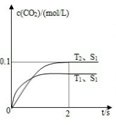
①在T2温度下,0~2s内的平均反应速率υ(N2)= ______________。
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2,在如图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
(4)①已知气缸中生成NO的反应为:N2(g)+O2(g) 2NO(g) △H>0,若1mol空气含0.8molN2和0.2molO2, 1300°C时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=____________。
2NO(g) △H>0,若1mol空气含0.8molN2和0.2molO2, 1300°C时在密闭容器内反应达到平衡,测得NO为8×10-4mol.计算该温度下的平衡常数K=____________。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:2CO(g)═2C(s)+O2(g)已知该反应的△H>0,简述该设想能否实现的依据:__________________。
-
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。
请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含离子的化学组分及其浓度如下表:
| 离子 | H+ | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol·L-1 | 未测定 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断试样的pH约为 。
(2)为减少SO2的排放,常采取的措施有:①将煤转化为清洁气体燃料。
已知:2H2(g)+O2(g)=2H2O(g) K1 2C(s)+O2(g)=2CO(g) K2
2C(s)+2H2O(g)=2CO(g)+2H2(g) K 则K=_____________(用含K1、K2的式子表示)。
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 。
A.Ca(OH) 2 B.Na2CO3 C.CaCl2 D.NaHSO3
(3)汽车尾气中有NOx和CO的生成及转化,已知汽缸中生成NO的反应为:
N2 (g)+O2(g) 2NO(g) △H
2NO(g) △H 0
0
目前,在汽车尾气系统中装置催化转化器可减少CO和NOx的污染,其化学反应方程式为 。
-
氮氧化物(用NOx表示)是大气污染的重要因素,根据NOx的来源和性质特点,已开发出多种化学治理其污染的方法。
(1)汽车尾气中的NO2是城市大气污染的主要污染物之一。在日光照射下,NO2发生一系列光化学烟雾的循环反应,从而不断产生O3,加重空气污染。反应过程为①2NO2→2NO+2O,②2NO+O2→2NO2,③O+O2→O3。下列关于该反应过程及生成物的叙述正确的是____(填序号)。
A.NO2起催化作用
B.NO起催化作用
C.NO2只起氧化作用
D.O3与O2互为同素异形体
(2)汽车尾气中的CO来自于____,NO来自于____。
(3)汽车尾气中的CO、NOx可在适宜温度下采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。写出NO被CO还原的化学方程式:_____。
(4)工业尾气中氮氧化物常采用碱液吸收法处理。NO2被烧碱溶液吸收时,生成两种钠盐,其物质的量之比为1∶1,该反应的离子方程式为____;1molNO2被完全吸收时,转移电子的物质的量为____。NO与NO2按物质的量之比1∶1被足量NaOH溶液完全吸收后只得到一种钠盐,该钠盐的化学式为____。
CH3OH(g) △H<0 在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气,一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是_______。
N2(g)+2CO2(g) △H<0 。则该反应在________________(填高温、低温或任何温度)下能自发进行。

N2(g)+2CO2(g),在恒温条件下,1 mol NO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:



