-
已知:①N2(g)+O2(g)===2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g)  2NH3(g) ΔH2=-92.4 kJ·mol-1
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)===2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是 ( )
A. 反应②中的能量变化如图所示:
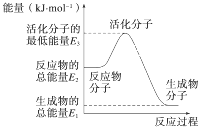
则ΔH2=E1-E3
B. H2的燃烧热为241.8 kJ·mol-1
C. 氨的催化氧化反应为4NH3(g)+5O2(g)===4NO(g)+ 6H2O(g) ΔH=+906 kJ·mol-1
D. 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,最终反应放出的热量小于92.4 kJ,
-
氮的氧化物是造成大气污染的主要物质。研究氮氧化物的反应机理对于消除环境污染有重要意义。
(1)已知:N2(g)+O2(g)=2NO(g);ΔH1=+180.5 kJ·mol-1
C(s)+O2(g)=CO2(g);ΔH2=-393.5 kJ·mol-1
2C(s)+O2(g)=2CO(g);ΔH3=-221 kJ·mol-1
反应2NO(g)+2CO(g)⇌N2(g)+2CO2(g)的ΔH=________ kJ·mol-1。
(2)催化氧化法去除NO是在一定条件下,用NH3消除NO污染,其反应原理为4NH3+6NO 5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1、3∶1、1∶3时,得到NO脱除率曲线如图所示:
5N2+6H2O。不同温度条件下,n(NH3)∶n(NO)的物质的量之比分别为4∶1、3∶1、1∶3时,得到NO脱除率曲线如图所示:
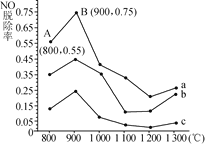
①n(NH3)∶n(NO)的物质的量之比为1∶3时,对应的是曲线________(填“a”“b”或“c”)。
②由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降的原因可能是____________。
(3)NO氧化反应:2NO(g)+O2(g)⇌2NO2(g)分两步进行,其反应过程能量变化示意图如图:
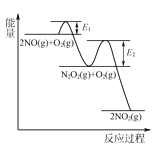
Ⅰ. 2NO(g)→N2O2(g);ΔH1
Ⅱ. N2O2(g)+O2(g)→2NO2(g);ΔH2
①化学反应速率有速率较慢的反应步骤决定。以上反应决定NO氧化反应速率的步骤是________(填“Ⅰ”或“Ⅱ”)。
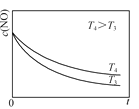
②在恒容的密闭容器中充入一定量的NO和O2气体,保持其他条件不变,控制反应温度分别为T3和T4(T4>T3),测得c(NO)随t(时间)的变化曲线如图。转化相同量的NO,在温度_____(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图分析其原因:______。
(4) NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图:
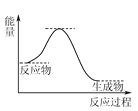
研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如图,写出脱硝过程的总反应方程式:_______。

-
运用化学反应原理消除工业污染,保护生态环境具有非常重要的意义。
(1)采取热还原法,用碳粉可将氮氧化物还原。
已知:①N2(g)+O2(g)=2NO(g) △H=+180.6kJ·mol-1;
②C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1。
则反应C(s)+2NO(g)=CO2(g)+N2(g) △H= kJ·mol-1。
(2)在催化剂作用下,将nmolSO2与nmolCl2充入容积可变的密闭容器中,发生反应:SO2(g)+ Cl2(g)  SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示。则v(SO2)= ___ mol/min。
②此温度下,该反应的K= 。
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是 。
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:
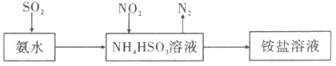
NO2被吸收的离子方程式是 。
(4)利用如下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。

①阴极的电极反应式为 。
②在碱性条件下,用阴极排除的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应的离子方程式为 。
-
NO、NO2是常见的氧化物。用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g)=N2(g)+O2(g) △H=-180.5kJ·mol-1
2H2O(l)=2H2(g)+O2(g) △H=+571.6kJ·mol-1
则用H2催化还原NO消除污染的热化学方程式是_____________________________。
-
拆开1 mol 共价键所吸收的能量或形成1 mol 共价键所释放的能量称为键能。已知:H-H键能为436 kJ /mol,H-N键能为391 kJ /mol, N2 (g)+ 3H2(g)  2NH3(g) △H=-92.4 kJ /mol,下列说法中正确的是( )
2NH3(g) △H=-92.4 kJ /mol,下列说法中正确的是( )
A. H-H比N≡N更牢固
B. N≡N键能约为946 kJ/mol
C. 合成氨反应选择适当的催化剂是为了提高H2的转化率
D. 0.5 mol N2和1.5 mol H2在题给条件下充分反应,放出热量为46.2 kJ
-
已知N≡N键能为946 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 + 3H2  2NH3 ΔH=-92 KJ/mol,则H—H键的键能是
2NH3 ΔH=-92 KJ/mol,则H—H键的键能是
A. < 436 KJ/mol B. 436 KJ/mol C. 497 KJ/mol D. 467 KJ/mol
-
下列说法中,能说明化学平衡一定向正反应方向移动的是
A.N2O4(g)  2NO2(g),改变某一条件后,气体颜色加深
2NO2(g),改变某一条件后,气体颜色加深
B.N2(g) + 3H2(g)  2NH3(g),改变某一条件后,NH3的体积分数增加
2NH3(g),改变某一条件后,NH3的体积分数增加
C.H2(g) + I2(g)  2HI(g),单位时间内消耗H2和HI的物质的量之比大于1∶2
2HI(g),单位时间内消耗H2和HI的物质的量之比大于1∶2
D.2SO2(g) + O2(g)  2SO3(g),恒温恒容充入He
2SO3(g),恒温恒容充入He
-
下列说法中,能说明化学平衡一定向正反应方向移动的是
A.N2O4(g)  2NO2(g),改变某一条件后,气体颜色加深
2NO2(g),改变某一条件后,气体颜色加深
B.N2(g) + 3H2(g)  2NH3(g),改变某一条件后,NH3的体积分数增加
2NH3(g),改变某一条件后,NH3的体积分数增加
C.H2(g) + I2(g)  2HI(g),单位时间内消耗H2和HI的物质的量之比大于1∶2
2HI(g),单位时间内消耗H2和HI的物质的量之比大于1∶2
D.2SO2(g) + O2(g)  2SO3(g),恒温恒容充入He
2SO3(g),恒温恒容充入He
-
(4分)已知拆开1mol H—H键, 1mol N三N键分别需要吸收的能量为436kJ , 946kJ;形成1mol N—H键,会放出能量391kJ,在反应N2 + 3H2  2NH3中,每生成2mol NH3 ____热量(填:吸收或放出)_____kJ(各2分)。
2NH3中,每生成2mol NH3 ____热量(填:吸收或放出)_____kJ(各2分)。
-
已知拆开1mol H–H键, 1mol N≡N键分别需要吸收的能量为436kJ 、946kJ;形成1mol N–H键,会放出能量391kJ,在反应N2 + 3H2  2NH3中,每生成2mol NH3,
2NH3中,每生成2mol NH3,
A.放出92 kJ热量 B.吸收92 kJ热量
C.放出209kJ热量 D.吸收209kJ热量
2NH3(g) ΔH2=-92.4 kJ·mol-1







