-
现有A、B、C、D、E五种元素,原子序数依次增大,且不超过36.A元素的基态原子最外层电子数是次外层的三倍;B元素的基态原子核外有13种不同运动状态的电子;C与B同一周期,原子中未成对电子数是同周期中最多的;D2-的核外电子排布与氩原子相同;E元素的基态原子价电子排布式为3d104s1.请根据相关信息,回答下列问题:
(1)在A、B、C、D四种元素中第一电离能最小的是___________,电负性最大的是___________ (用相应的元素符号表示)
(2)写出DA2的水化物在水中的电离方程式___________.DA3是___________分子(填“极性”或“非极性”)
(3)A、C的简单氢化物中,哪种物质的沸点高,原因是什么? ___________________________
(4)若[E(NH3)4]2+具有对称的空间构型,且当[E(NH3)4]2+中的两个NH3分子被两个Cl-取代时,能得到两种不同结构的产物,则[E(NH3)4]2+的空间构型为_________ (填序号)
a.正四面体 b.平面正方形 c.三角锥形 d.V形
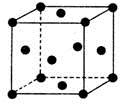
(5)单质E晶胞如图所示,已知E元素相对原子质量为M,原子半径为a pm,密度为dg·cm-3(1pm=10-10cm)写出阿伏加德罗常数NA的表达式___________.(用M、a、d表示)
-
现有A、B、X、Y、Z五种短周期元素,原子序数依次增大.它们的性质或原子结构如下表:
| 元素 | 性质或原子结构 |
| A | 原子核内只有一个质子 |
| B | 单质是空气中含量最多的气体 |
| X | 原子的最外层电子数是次外层电子数的3倍 |
| Y | 短周期元素中原子半径最大的元素 |
| Z | 最高正化合价与最低负化合价的代数和为6 |
请回答:
(1)X元素在元素周期表中的位置是______.
(2)Z单质通入Y 的最高价氧化物对应水化物的溶液中,可以得到漂白液,相应反应的离子方程式为______.
(3)化合物甲由A和B两种元素组成且质量比为3:14.甲与X单质在催化剂、加热条件下发生的反应是工业上制取硝酸的基础,写出该反应的化学方程式______△4NO+6H2O
-
现有A、B、C、D、E、五种短周期元素,它们的原子序数依次增大。A组成的单质是最轻的气体;B的原子最外层电子数为次外层的两倍; D为第三周期元素中原子半径最大的元素;C和D两种元素核外电子总数之和为19;E元素的最高价氧化物对应水化物的酸性最强。据此信息,回答下列问题:
(1)A位于元素周期表中第__________周期第__________族。
(2)画出C的原子结构示意图_________________。
(3)写出含有18个中子的E的一种原子符号_____________。
(4)B的原子半径____________(填“大于” 、“小于”或“等于”) C的原子半径。由B和C组成的AB2型化合物属于____________________化合物(填“离子”或“共价” ),该化合物中含有____________________________(填“离子键”、“共价键”或“离子键和共价键” )。
(5)由B、C、D三种元素组成的化合物的化学式是_________________________,其物质分类属于_____________________(填“酸” 、“碱”或“盐” )。
-
现有A、B、C、D、E为五种原子序数依次增大的短周期主族元素,A原子的最外层电子数是其内层电子数的一半;B和D原子最外层电子数之比为1:1,而两者的原子序数之比为1:2;C元素的氢氧化物既能溶于强碱又能溶于强酸溶液。下列说法正确的是( )
A. A与E的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为rA<rB<rC<rD<rE
C. 离子B2-与C3+的核外电子数和电子层数都不相同
D. 元素D的最高价氧化物对应水化物的酸性比E的强
-
现有A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,A原子的最外层电子排布式为1s1。B和D也属同一族,它们原子最外层的p能级与s能级的电子数之比是2∶1,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)以上这五种元素中,属于s区的是_________(填元素符号)。
(2)由这五种元素组成的一种化合物是_________________________(填化学式)。
(3)写出D元素基态原子的最外层电子排布图:____________________。
(4)元素电负性:B__________D,元素第一电离能:C________E。(填“>”“<”或“=”)
-
现有5种短周期元素X、Y、Z、Q、W,原子序数依次增大,在周期表中X原子半径最小;X和W同主族;Y元素原子核外电子总数是其次外层电子数的3倍;Q元素是地壳中含量最高的元素。下列说法不正确的是( )
A.ZX3可使紫色石蕊溶液变蓝
B.X、Z、Q 3种元素可组成离子化合物或共价化合物
C.离子半径:Z<Q<W
D.X2Q2、Y2X6 2种分子中含有的电子数、化学键种类都相同
-
现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6 ;E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能________B(填“<”“>”或“=”),A、B、C三种元素电负性由小到大的顺序为________(用元素符号表示)。
(2)D元素原子的价电子排布式是________。
(3)C元素的电子排布图为________________;E3+的离子符号为________________。
(4)F元素位于元素周期表的________区,其基态原子的电子排布式为________________。
(5)G元素可能的性质________。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
-
现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的 ;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)G的元素名称为__________________
(2)A、B、C三种元素电负性由大到小的顺序为_____________________(用元素符号表示),第一电离能D _______Al(填“>”“<”或“=”),其原因是___________________________。
(3)C元素的电子排布图为__________________;E3+的离子符号为__________________
(4)F元素位于元素周期表的______区,其基态原子的电子排布式为___________________
(5)G元素可能的性质_______________
A.其单质可作为半导体材料 B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸 D.其第一电离能小于硒
-
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D原子核外哑铃形原子轨道上有2个未成对电子,D与A形成的化合物分子构型是V型。B元素是形成化合物种类最多的元素,A、B的最外层电子数之和与C的最外层电子数相等,F是同周期第一电离能最小的元素。
(1)写出C元素基态原子的价电子排布式________;B、C、D三种元素电负性由大到小的顺序为(用元素符号表示)________;
(2)E与A能形成分子式为EA的化合物。接近EA沸点的EA蒸气的相对分子质量测量值要大于其分子计算值,原因是________;C、D分别与A形成最简单分子中,稳定性较高的是________(填化学式)分子;该分子再与A+结合成离子时,ACA键的键角会________(填“变大”、“不变”或“变小”)
(3)C与F形成的化合物FC3中,C3的空间构型为________,C3—中心原子采用________杂化。灼烧FC3时,火焰呈现特殊颜色,请从原理上解释产生该现象的原因:________。
(4)右图为B元素的某种单质晶体的晶胞,则该晶体中B原子的空间占有率为________(用r表示B的原子半径,用带r的表达式表示,不必简化)

-
(8分)现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能 B,元素的电负性由小到大的顺序为一电离能(填“<”“>”或“=”),A、B、C三种元素 (用元素符号表示)。
(2)D元素原子的价电子排布式是 。
(3)C元素的电子排布图为 ;E3+的离子符号为 。
(4)F元素位于元素周期表的 区,其基态原子的电子排布式为 。
(5)G元素可能的性质 。
A.其单质可作为半导体材料 B.其电负性大于磷 C.最高价氧化物对应的水化物是强酸
