-
[化学--选修化学与技术]
磷化铝、磷化锌、磷化钙是我国目前最常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦(PH3),PH3具有较强的还原性,能在空气中自然.我国粮食卫生标准(GB2175-2005)规定,粮食中磷化物(以PH3计)含量≤0.05mg/kg.
通过下列方法对粮食中残留磷化物含量进行测定.
[实验课题]粮食中残留磷化物的定量测定
[实验原理]5PH3+8KMnO4+12H2SO4=5H3PO4+8MnSO4+4K2SO4+12H2O2KMnO4+5Na2SO3+3H2SO4=2MnSO4+K2SO4+5Na2SO4+3H2O
[操作流程]安装蒸馏吸收装置→PH3的产生与吸收→转移褪色→亚硫酸标准溶液滴定
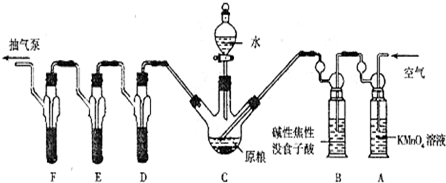
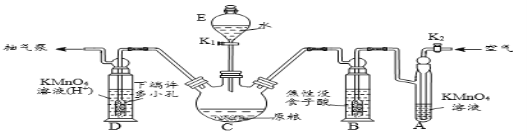
[实验装置]
C中盛有200g原粮;D、E、F各盛装1.00mL浓度为1.00×10-3mol/L的KMnO4的溶液(H2SO4酸化)
(1)以磷化铝为例,写出磷化物与水反应的化学方程式______.
(2)检查上述装置气密性的方法是______.
(3)实验过程中,用抽气泵抽气的目的是______.
(4)A中盛装KmnO4溶液是为除去空气中可能含有的______;B中盛装碱性焦性没食子酸溶液的作用是______;如去除B装置,则实验中测得的PH3含量将______.
(5)收集D、E、F所得吸收液,并洗涤D、E、F,将吸收液、洗涤液一并置于锥形瓶中,加水稀释至25mL,用浓度为5×10-4mol/L Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为______mg/kg.
-
磷化铝、磷化锌、磷化钙是目前常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦(PH3),PH3具有较强的还原性,能在空气中自燃。卫生安全标准规定,粮食中磷化物(以PH3计)含量≤0.05mg/kg。某化学兴趣小组的同学通过下列方法对粮食中残留磷化物含量进行研究:
【操作流程】安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸标准溶液滴定
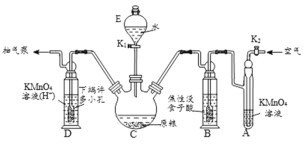
【实验装置】
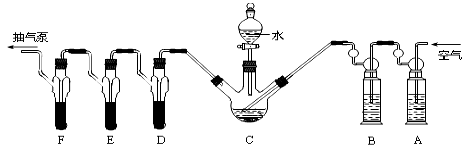
C中盛有200g原粮,D、E、F 各盛装1.00mL浓度为1.00×10-3mol/L的KMnO4 溶液(H2SO4 酸化)。
请回答下列有关问题:
(1)仪器G的名称是 。以磷化铝为例,写出磷化铝与水反应的化学方程式 。
(2)检查C装置气密性的方法是:用止水夹夹紧C装置 ,取下上口活塞,漏斗中加入水,打开下口旋塞,观察到 ,表明装置气密性良好。
(3)实验过程中,用抽气泵反复抽气的目的是 。
(4)A中盛装KMnO4溶液是为除去空气中可能含有的 (填“还原”或“氧化”)性气体;B中盛装新制FeSO4溶液的作用是 ;
(5)已知 D、E、F 中发生同一反应,实验中 PH3被氧化成磷酸,写出所发生的化学反应方程式 ;收集装置D、E、F所得吸收液,并洗涤D、E、F,将吸收液、洗涤液一并置于锥形瓶中,加水稀释至25mL,用浓度为5×10-4 mol/LNa2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为 mg/kg。
-
磷化铝、磷化锌、磷化钙是目前常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦(PH3),PH3具有较强的还原性,能在空气中自燃。卫生安全标准规定,粮食中磷化物(以PH3计)含量≤0.05mg/kg。某化学兴趣小组的同学通过下列方法对粮食中残留磷化物含量进行研究:
【操作流程】安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸标准溶液滴定
【实验装置】
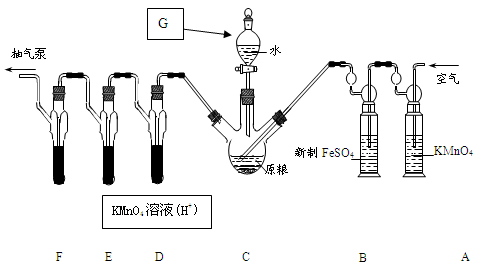
C中盛有200g原粮;D、E、F 各盛装1.00mL浓度为1.00×10-3mol/L的KMnO4溶液(H2SO4酸化)。
请回答下列有关问题:
(1)仪器G的名称是 , 以磷化铝为例,写出磷化铝与水反应的化学方程式 。
(2)检查C装置气密性的方法是:用止水夹夹紧C装置 ,取下上口活塞,漏斗中加入水,打开下口旋塞,观察到 ,表明装置气密性良好。
(3)实验过程中,用抽气泵反复抽气的目的是 。
(4)A中盛装KMnO4溶液是为除去空气中可能含有的 (填“还原”或“氧化”)性气体; B中盛装新制FeSO4溶液的作用是 ;
(5)已知D、E、F中发生同一反应,实验中PH3被氧化成磷酸,写出所发生的化学反应方程式: ;
收集装置D、E、F所得吸收液,并洗涤D、E、F,将吸收液、洗涤液一并置于锥形瓶中,加水稀释至25mL,用浓度为5×10-4mol/LNa2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为 mg/kg。
-
磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强、易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05mg·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:
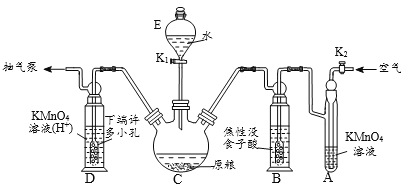
(操作流程)安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸钠标准溶液滴定。
(实验装置)C中盛100 g原粮,D中盛有 20.00 mL 1.12×10-4 mol • L-1KMnO4溶(H2SO4酸化)。
请回答下列问题:
(1)仪器C的名称是_________;原粮最好先打成粉末,其原因是_____________。
(2)磷化钙与水反应有化学方程式为_____________________________________;检查整套装置气密性良好的方法是_______________________________________。
(3)A中盛装KMnO4溶液的作用是除去空气中的还原性气体;B中盛装焦性没食子酸的碱性溶液,其作用是吸收空气中的O2,防止___________;通入空气的作用是____________。
(4)D中PH3被氧化成磷酸,所发生反应的离子方程式为_________________________。
(5)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5mol • L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗标Na2SO3准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为______mg • kg-1,该原粮质量________(填“合格”或“不合格”)。
-
磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强、易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05mg·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:
(操作流程)安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸钠标准溶液滴定。
(实验装置)C中盛100 g原粮,D中盛有 20.00 mL 1.12×10-4 mol • L-1KMnO4溶(H2SO4酸化)。
(1)仪器C的名称是_________;原粮最好先打成粉末,其原因是_____________。
(2)磷化钙与水反应化学方程式为_____________________________________;检查整套装置气密性良好的方法是_______________________________________。
(3)A中盛装KMnO4溶液的作用是除去空气中的还原性气体;B中盛装焦性没食子酸的碱性溶液,其作用是吸收空气中的O2,防止___________;通入空气的作用是____________。
(4)D中PH3被氧化成磷酸,所发生反应的离子方程式为_________________________。
(5)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5mol • L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,写出该反应的离子方程式________________,消耗标Na2SO3准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为______mg • kg-1。
(6)滴定结束的现象_____________________。
-
磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强、易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05mg·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:
(操作流程)安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸钠标准溶液滴定。
(实验装置)C中盛100g原粮,D中盛有20.00mL1.12×10-4mol•L-1KMnO4溶液(H2SO4酸化)。
请回答下列问题:
(1)仪器E的名称是___,该仪器可否用于分液操作___?(答“能”或“不能”)
(2)以磷化钙为例,写出磷化钙与水反应除了生成PH3之外,另一产物的电子式是___;检查整套装置气密性的方法是关闭___打开___,抽气泵缓慢抽气,若观察到___(填字母)装置中有气泡产生则气密性良好。
(3)A中盛装KMnO4溶液的作用是___;通入空气的作用是___。焦性没食子酸可以吸收氧化性气体,若没有B装置,则实验中测得PH3含量将___(填“偏低”、“偏高”或“不变”)
(4)D中PH3被氧化成磷酸,所发生反应的离子方程式为___。
(5)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5mol•L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为___ mg•kg-1。
-
磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强、易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05mg·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:

(操作流程)安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸钠标准溶液滴定。
(实验装置)C中盛100 g原粮,D中盛有 20.00 mL 1.12×10-4 mol • L-1KMnO4溶(H2SO4酸化)。
请回答下列问题:
(1)仪器C的名称是__________________;
(2)以磷化钙为例,写出磷化钙与水反应的化学方程式____________________;检查整套装置气密性良好的方法是_____________________________________。
(3)A中盛装KMnO4溶液的作用是______________________;通入空气的作用是____________。若没有B装置,则实验中测得PH3含量将____________(填“偏低”、“偏高”或“不变”)
(4)D中PH3被氧化成磷酸,所发生反应的离子方程式为_________________________。
(5)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5mol • L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为______mg • kg-1。
-
磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强、易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05mg·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:
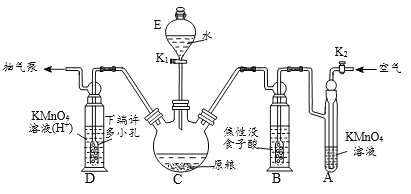
【操作流程】安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸钠标准溶液滴定。
【实验装置】C中盛100 g原粮,D中盛有 20.00 mL 1.12×10-4 mol • L-1KMnO4溶(H2SO4酸化)。
请回答下列问题:
(1)仪器C的名称是_________;原粮最好先打成粉末,其原因是_____________。
(2)磷化钙与水反应有化学方程式为_____________________________________;检查整套装置气密性良好的方法是_______________________________________。
(3)A中盛装KMnO4溶液的作用是除去空气中的还原性气体;B中盛装焦性没食子酸的碱性溶液,其作用是吸收空气中的O2,防止___________;通入空气的作用是____________。
(4)D中PH3被氧化成磷酸,所发生反应的离子方程式为_________________________。
(5)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5mol • L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗标Na2SO3准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为______mg • kg-1,该原粮质量________(填“合格”或“不合格”)。
-
磷化铝(AlP)通常可作为一种广谱性熏蒸杀虫剂,吸水后会立即产生高毒性PH3气体(熔点为-132°C,还原性强)。卫生安全标准规定:粮食中磷化物(以PH3计)的含量不超过0.05mg·kg-1时,粮食质量合格;反之,粮食质量不合格。某化学兴趣小组的同学通过下列方法对粮食中残留的磷化物含量进行了探究。
【操作流程】
安装实验装置→PH3的产生与吸收→转移KMnO4吸收溶液→滴定亚硫酸钠标准溶液
【实验装置】
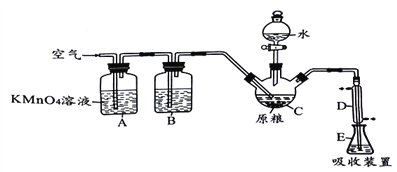
已知装置C中盛有l00g原粮,装置E中盛有20.00mLl.ll×l0-3 mol·L-1 KMnO4溶液(H2SO4酸化)。
回答下列问题:
(1)仪器D的名称是____________________________________。
(2)装置B中盛有焦性没食子酸的碱性溶液,其作用是吸收空气中的O2,防止装置C中生成的PH3被氧化,则装置A中盛装KMnO4溶液的作用是_____________________________。
(3)通入空气的作用是_____________________________。
(4)已知PH3被氧化成磷酸,则装置E中发生反应的离子方程式为___________________________。
(5)收集装置E中的吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×l0-4 mol·L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为________________mg·kg-1,该原粮质量是否合格?________________(填“合格”或“不合格”)
-
磷化铝(AlP)是一种常用于粮食仓储的广谱性熏蒸杀虫剂,遇水立即产生高毒性气体PH3(沸点-89.7℃,还原性强)。国家卫计委规定粮食中磷化物(以PH3计)的残留量不超过0.05mg/kg时为质量合格,反之不合格。某化学兴趣小组的同学用下述方法测定某粮食样品中残留磷化物的质量以判断是否合格。

在C中加入100g原粮,E中加入20.00mL2.50×10-4mol/ L KMnO4溶液(H2SO4酸化),往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的KMnO4溶液。回答下列问题:
(1)PH3的电子式为___________。仪器D的名称是___________。
(2)通入空气的作用是___________。
(3)装置B中盛装焦性没食子酸的碱性溶液,其作用是吸收空气中的O2。若去掉该装置,对实验的影响为___________。
(4)装置E中PH3被氧化成磷酸,则装置E中发生反应的离子方程式为__________。收集装置E中的吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用4.0×10-5mol/L的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液20.00mL,Na2SO3与KMnO4溶液反应的离子方程式为:SO32-+MnO4-+H+→SO42-+Mn2++H2O(未配平),则该原粮样品中磷化物(以PH3计)的质量为__________mg。该原粮样品__________(填“合格”或“不合格”)









