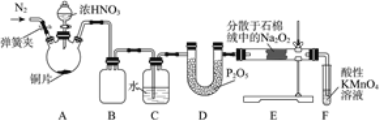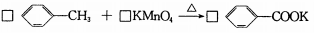-
亚硝酸钠(NaNO2)是一种重要的化工原料,某学习小组通过下述实验制备亚硝酸钠,并测定所制备亚硝酸钠的纯度。
(一)利用下列装置制备NaNO2。
已知:①2NO+Na2O2=2NaNO2;② NO和NO2-均能被酸性高锰酸钾氧化为NO3-。
(1)选择上述仪器完成实验,其连按顺序为_______________(按气流方向,用小写字母表示)。
(2)装置A中m管的作用为_________________。
(3)装置B中发生反应的离子方程式为____________________________________________________。
(二)测定上述实验所制备的NaNO2样品(含NaNO3和Na2CO3 杂质)的纯度。
称量D中所得样品ag溶解后配制成250 mL 溶液,取25.00mL于锥形瓶用6mol·L-1 的酸性高锰酸钾溶液滴定到终点;重复上述滴定操作两次,测得数据如下表:
| 第一次 | 第二次 | 第三次 |
| 酸性高锰酸钾溶液休积/mL | 19.98 | 19.75 | 20.02 |
(4)盛装酸性高锰酸钾溶液前需对酸式滴定管进行的操作为__________________________。
(5)滴定到终点的实验现象为_________________________________________________。
(6)下列实验操作可能导致出现上表中第二次实验数据的是________(填字母编号)。
a.滴定时有部分酸性高锰酸钾溶液滴在锥形瓶外
b.加入样品溶液前的锥形瓶未经干燥
c.滴定前仰视读数,滴定后俯视读数
(7)最终所得样品中NaNO2 的质量分数为_____________(用含a、b的关系式表示)。
-
(亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。实验室利用下图装置制备亚硝酸钠,并测定所制亚硝酸钠的纯度。(加热装置及部分夹持装置已略去)
Ⅱ.亚硝酸钠纯度的测定。
当Na2O2完全反应后,E中产生的固体除NaNO2外,还可能有NaNO3。测定亚硝酸钠纯度的步骤如下:
步骤一:取反应后的固体4.30 g溶于稀硫酸,向所得溶液中加入足量KI,将溶液中的NO2-和NO3-全部还原为NO,并通入足量N2,将NO全部赶出,最后将溶液稀释至1000 mL。
步骤二:取上述所得溶液10 mL,用淀粉作指示剂,用0.050 mol/L的Na2S2O3标准液滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,最终消耗Na2S2O3溶液体积为16.00 mL。
(1)步骤二中达到滴定终点的标志为______________________。
(2)混合固体中NaNO2的质量分数为________。(保留三位有效数字)
(3)若在滴定终点读取滴定管刻度时,仰视标准液液面,则测得亚硝酸钠的纯度________。(填“偏高”“偏低”或“无影响”)
-
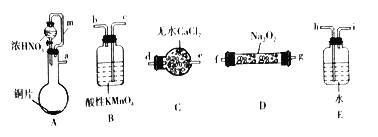
亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。实验室利用下图装置制备亚硝酸钠,并测定所制亚硝酸钠的纯度。(加热装置及部分夹持装置已略去)
Ⅰ.亚硝酸钠的制备。
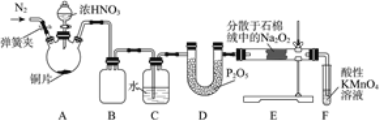
(1)盛放浓HNO3的仪器的名称为__________;装置B的作用是______________。
(2)装置E中制取NaNO2的化学方程式为___________________。
(3)多余的NO在装置F中被氧化为NO3-,反应的离子方程式为_____________。
(4)实验结束后打开A中弹簧夹,通入N2的目的是_______________。
Ⅱ.亚硝酸钠纯度的测定。
当Na2O2完全反应后,E中产生的固体除NaNO2外,还可能有NaNO3。测定亚硝酸钠纯度的步骤如下:
步骤一:取反应后的固体4.30 g溶于稀硫酸,向所得溶液中加入足量KI,将溶液中的NO2-和NO3-全部还原为NO,并通入足量N2,将NO全部赶出,最后将溶液稀释至1000 mL。
步骤二:取上述所得溶液10 mL,用淀粉作指示剂,用0.050 mol/L的Na2S2O3标准液滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,最终消耗Na2S2O3溶液体积为16.00 mL。
(5)步骤二中达到滴定终点的标志为______________________。
(6)混合固体中NaNO2的质量分数为________。(保留三位有效数字)
(7)若在滴定终点读取滴定管刻度时,仰视标准液液面,则测得亚硝酸钠的纯度________。(填“偏高”“偏低”或“无影响”)
-
亚硝酸钠(NaNO2)是工业盐的主要成分,在漂白、电镀等方面应用广泛。实验室利用下图装置制备亚硝酸钠,并测定所制亚硝酸钠的纯度。(加热装置及部分夹持装置已略去)
Ⅰ.亚硝酸钠的制备。
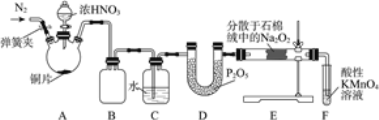
(1)盛放浓HNO3的仪器的名称为__________;装置B的作用是______________。
(2)装置E中制取NaNO2的化学方程式为___________________。
(3)多余的NO在装置F中被氧化为NO3-,反应的离子方程式为_____________。
(4)实验结束后打开A中弹簧夹,通入N2的目的是_______________。
Ⅱ.亚硝酸钠纯度的测定。
当Na2O2完全反应后,E中产生的固体除NaNO2外,还可能有NaNO3。测定亚硝酸钠纯度的步骤如下:
步骤一:取反应后的固体4.30 g溶于稀硫酸,向所得溶液中加入足量KI,将溶液中的NO2-和NO3-全部还原为NO,并通入足量N2,将NO全部赶出,最后将溶液稀释至1000 mL。
步骤二:取上述所得溶液10 mL,用淀粉作指示剂,用0.050 mol/L的Na2S2O3标准液滴定,发生的反应为I2+2Na2S2O3=2NaI+Na2S4O6,最终消耗Na2S2O3溶液体积为16.00 mL。
(5)步骤二中达到滴定终点的标志为______________________。
(6)混合固体中NaNO2的质量分数为________。(保留三位有效数字)
(7)若在滴定终点读取滴定管刻度时,仰视标准液液面,则测得亚硝酸钠的纯度________。(填“偏高”“偏低”或“无影响”)
-
(15分)苯甲酸是一种重要的化工原料。实验室合成苯甲酸的原理、有关数据及装置示意图如下:
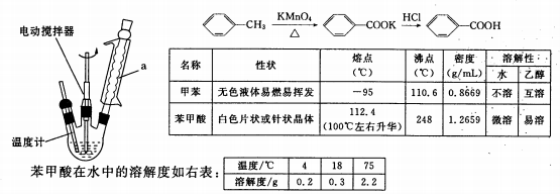
某学习小组在实验室制备、分离、提纯苯甲酸,并测定所得样品的纯度,步骤如下:
一、制备苯甲酸
在三颈瓶中加人2.7 mL甲苯、100 mL水和2~3片碎瓷片,开动电动搅拌器,a中通入流动水,在石棉网上加热至沸腾,然后分批加人8.5 g高锰酸钾,继续搅拌约4~5h,直到甲苯层几乎近于消失、回流液不再出现油珠,停止加热和搅拌,静置。
二、分离提纯
在反应混合物中加人一定量草酸(H2C204)充分反应,过滤、洗涤,将滤液放在冰水浴中冷却,然后用浓盐酸酸化,苯甲酸全部析出后减压过滤,将沉淀物用少量冷水洗涤,挤压去水分后放在沸水浴上干燥,得到粗产品。
三、测定纯度
称取mg产品,配成100 mL乙醇溶液,移取25.00 mL溶液于锥形瓶,滴加2~3滴酚酞,然后用标准浓度KOH溶液滴定。
请回答下列问题:
(1)装置a的名称是____,其作用为_________
(2)甲苯被高锰酸钾氧化的原理为:
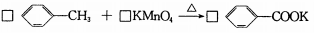

请完成并配平该化学方程式。
(3)分离提纯过程中加人的草酸是一种二元弱酸,反应过程中有酸式盐和无色气体生成。加人草酸的作用是 ,请用离子方程式表示反应原理
(4)产品减压过滤时用冷水洗涤的原因是
(5)选用下列 操作,可以将粗产品进一步提纯。(选填字母)
A、溶于水后过滤 B、溶于乙醇后蒸馏
C、用甲苯萃取后分液 D、升华
(6)测定纯度步骤中,滴定终点溶液的颜色变化是____。若m=1.200 g,滴定时用去0.1200 mol· L-1标准KOH溶液20.00 mL,则所得产品中苯甲酸的质量分数为
-
Mn2O3是一种重要的工业原料,在电磁和有机合成等领域应用广泛。某学习小组在实验室用CH4还原MnO2制备Mn2O3,并测定产品纯度。请回答下列问题:
Ⅰ.制备(实验装置如图所示)
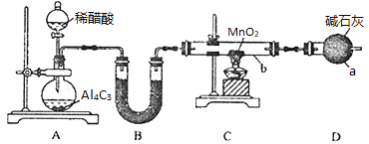
已知:Al4C3+12H2O==4Al(OH)3+3CH4↑。
(1)仪器a的名称为______________________
(2)用稀醋酸代替水的优点有________________________________________
(3)连接好实验装置,检验装置的气密性并加入相应试剂。向烧瓶中滴加稀醋酸之后,在点燃酒精灯之前应进行的操作是__________________________________
(4)仪器b中同时生成两种能参与大气循环的物质,该反应的化学方程式为______________
(5)指出上述实验装置有一处明显的缺陷____________________________
Ⅱ.测定产品中Mn2O3的纯度(只考虑产品中混有少量未参与反应的MnO2)
ⅰ.实验结束后,取仪器b中所得固体7.19g,加入足量硫酸酸化的KI溶液,使固体中锰元素全部转化为Mn2+;
ⅱ.将所得溶液稀释至500mL;
ⅲ.取25.00mL稀释后的溶液,滴加几滴淀粉溶液,用0.200mol∙L-1的Na2S2O3标准溶液滴定,达到滴定终点时,消耗25.00mLNa2S2O3标准溶液。(已知:I2+2 Na2S2O3==Na2S4O6+2NaI)
(1)步骤ⅰ中发生反应的离子方程式为________________________________________
(2)滴定终点的标志是__________________________________________________
(3)所取固体中Mn2O3的质量分数为___________________(计算结果精确到0.1%)
(4)下列操作使测定结果偏高的是______________
A.滴定前平视,滴定终点俯视读数
B.盛放Na2S2O3标准溶液的滴定管未用标准液润洗
C.硫酸酸化的KI溶液在空气中静置时间过长
D.滴定前正常,滴定后滴定管尖嘴内有气泡
-
亚硝酰氯 是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用
是有机物合成中的重要试剂,为红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用 和NO制备ClNO并测定其纯度。请回答:
和NO制备ClNO并测定其纯度。请回答:
I.甲组的同学拟制备原料气NO和 ,制备装置如下图所示:
,制备装置如下图所示:
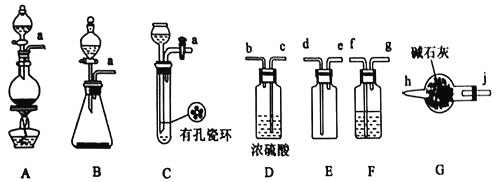
(1)若制备 发生装置选B,则反应的离子方程式为_________________。若制备NO发生装置也选B,锥形瓶中放的是Cu片,则分液漏斗中的试剂为_______。
发生装置选B,则反应的离子方程式为_________________。若制备NO发生装置也选B,锥形瓶中放的是Cu片,则分液漏斗中的试剂为_______。
(2)欲收集一瓶干燥纯净的氯气,选择装置其连接顺序为: ___
___ ___
___ ___
___ ___
___ ___
___ ___
___ 按气流方向,用小写字母表示
按气流方向,用小写字母表示 ,其中F装置的作用为________。
,其中F装置的作用为________。
II.乙组同学利用甲组制得的NO和 制备NOCl,装置如图所示:
制备NOCl,装置如图所示:


(3)为了使气体充分反应,从A处进入的气体是_______ 填
填 或
或 。
。
(4)装置Ⅲ、Ⅳ除可干燥NO、 外,另一个作用是_________________。
外,另一个作用是_________________。
(5)装置Ⅷ的烧杯中盛放的试剂是______ 填编号:
填编号: 水
水  热水
热水  冰水
冰水
-
(12分)亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量。某兴趣小组拟制备NaNO2并测定产品纯度。
I【查阅资料】
①2NO+Na2O2=2NaNO2;2NO2+Na2O2=2NaNO3。
②NO能被酸性高锰酸钾氧化成NO2。
③酸性条件下MnO4-被还原为Mn2+。
Ⅱ【制备产品】
用如下装置制NaNO2(夹持和加热装置已省略)。
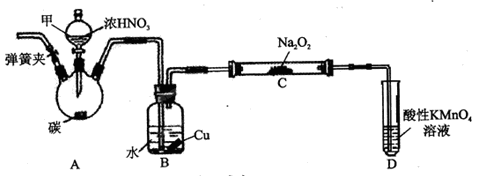
(1)装置A烧瓶中发生反应的化学方程式为_______________________。
(2)B装置的作用是_________________________。
(3)有同学认为装置C中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,为排除干扰应在B、C装置间增加装置E,E中盛放的试剂可能是_________。(填字母编号)
A.浓H2SO4 B.碱石灰 C.无水CaCl2 D.生石灰
Ⅲ【测定纯度】.
设计如下方案测定产品的纯度。

(4)溶液A到溶液B发生反应的离子方程式为____________________________。
(5)取样品2.3g经一系列操作后得到溶液A100mL,准确量取10.00mL A与24.00mL 0.05mol/L的酸性KMnO4溶液在锥形瓶中充分反应。反应后溶液用0.1 mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去;重复上述实验2次,平均消耗(NH4)2 Fe(SO4)2溶液10.00ml,则样品中NaNO2的纯度为__________。
Ⅳ【探究反思】
(6)NaNO2的纯度偏低,该小组讨论提出的原因中可能正确的是________。(填字母编号)
A.滴定至溶液紫色刚好褪去就立刻停止滴加
B.加入A与KMnO4溶液前锥形瓶未经干燥
C.实验中使用的(NH4)2 Fe(SO4)2溶液暴露在空气中时间过长
-
氮化钙(Ca3N2)是一种重要的化学试剂。某化学兴趣小组拟制备氮化钙并测定产品纯度。
已知:①氮化钙极易与水反应;②实验室在加热条件下用饱和NaNO2溶液和饱和(NH4)2SO4溶液混合制备N2;③焦性没食子酸溶液用于吸收少量O2。
I.制备氮化钙。
他们选择下列装置设计实验(装置可重复使用):
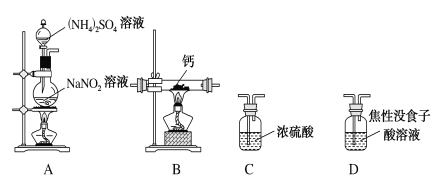
(1)实验室将钙保存在________中(填物质名称)。氮化钙中所含化学键类型是_________。
(2)气体从左至右,装置连接顺序为____________________________。(填代号)
(3)写出A中发生反应的化学方程式:______________________________。
(4)用化学方法检验氮化钙(Ca3N2)产品中是否混有Ca,设计实验方案:________。
Ⅱ.测定产品纯度。
利用如图装置测定氮化钙产品纯度(杂质不产生气体,氨气不溶于煤油)。
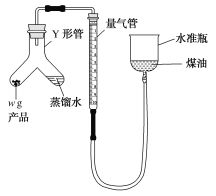
(5)当产品与蒸馏水完全反应后,冷却至室温、调平液面、读数。调平液面的操作是___________________________________。
(6)取产品质量为w g,开始量气管读数为V1 mL,最终量气管读数为V2 mL(折合成标准状况),则该样品纯度为________________________(用代数式表示)。如果开始仰视刻度线,终点时俯视刻度线,则测得结果________(填“偏高”“偏低”或“无影响”)。
-
亚硝酸钠(NaNO2) 是一种工业盐,外观与食盐相似。下面是某学习小组设计的NaNO2制取实验和纯度检验实验。该小组收集了相关资料:
①SO2 和HNO3溶液反应生成NOx 和H2SO4
②3NO2-+2H+=2NO↑+NO3-+H2O
③NO2-+Ag+=AgNO2↓(AgNO2为淡黄色接近白色固体,在水中形成沉淀)
Ⅰ.亚硝酸钠的制取实验
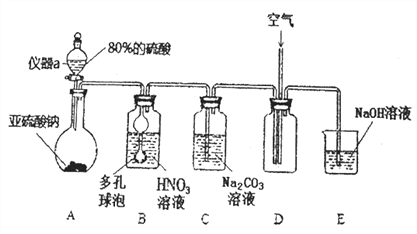
(1) 仪器a的名称为________________________,A装置中发生的化学反应方程式为_____________________________________________。
(2)B装置中多孔球泡的作用是_________________________________________________。
(3)若装置B中逸出的NO与NO2气体物质的量之比为2∶1,则装置B中发生反应的化学方程式为_________________________________________________________。
(4)实验过程中需控制C装置中溶液pH>7,否则C中生成的NaNO2的产量会下降,理由是_____________________________________________________。
(5) 请根据题干所给信息设计实验证明C装置中有NO2产生:_________________________________。(限选用的试剂: 稀硝酸、硝酸银溶液、NaOH溶液)
Ⅱ.亚硝酸钠的纯度检验
已知:NO2- + MnO4-+ H+→NO3-+ Mn2++H2O
(6)反应结束后C中溶液通过结晶获得NaNO2粗产品mg,溶解后稀释至250mL,分别取25.00mL用cmol/L的酸性KMnO4溶液平行滴定三次,平均每次消耗酸性KMnO4溶液的体积为VmL。则粗产品中NaNO2的质量分数为_____________(用含c、V、m的式子表示)。