-
(12分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入lmol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g)  CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.
CH3OH(g)+H2O(g) △H = —49.0kJ/mo1.
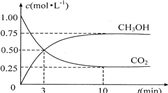
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,氢气的平均反应速率v(H2)=mol/(L·min)
(2)该反应的平衡常数为。
(3)下列措施中能使n(CH3OH)/n(CO2)增大的是________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入lmol CO2和3mol H2
(4)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H= —1275.6kJ/mol
②H2O(g)=H2O(1) △H= —44.0kJ/mol
则甲醇的燃烧热化学方程式为:;
(5)如果燃烧甲醇会造成大量化学能损失,如果以甲醇和空气为原料,以氢氧化钠为电解质溶液设计成原电池将有很多优点,请书写出该电池的负极反应:___________________
(6)常温下,某水溶液M中存在的离子有:Na+、A—、H+、OH—。若该溶液M由 pH=3的HA溶液 mL与pH=11的NaOH溶液
mL与pH=11的NaOH溶液 mL混合反应而得,则下列说法中正确的是__。
mL混合反应而得,则下列说法中正确的是__。
A.若溶液M呈中性,则溶液M中c(H+)+c(OH—)=2×10—7mol·L-1
B.若V1=V2,则溶液M的pH一定等于7
C.若溶液M呈酸性,则V1一定大于V2
D.若溶液M呈碱性,则V1一定小于V2
-
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=-49.0kJ/mol,测得CO2和CH3OH(g)的浓度随时间变化如图所示.
①从反应开始到平衡,氢气的平均反应速率v(H2)=________mol/.
②该反应的平衡常数表达式为________.
③下列措施中能使n(CH3OH)/n(CO2)增大的是________.
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH--4e-=O2↑+2H2O,则阴极反应式为:________.
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染.请你判断是否可行并说出理由:________.
-
(14分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,在500oC下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g);△H=-49.0kJ/mol
CH3OH(g)+H2O(g);△H=-49.0kJ/mol
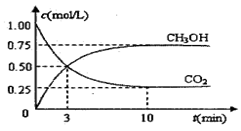
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
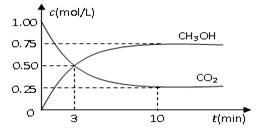
①从反应开始到平衡,氢气的平均反应速率
v(H2)=______________________________;
②该反应的平衡常数K为__________(精确到小数点后两位)。若提高温度到800oC进行达平衡时;K值__________,n(CH3OH)/n(CO2)比值__________(以上两空填“增大”、“减小”或“不变”);
③平衡时CH3OH的体积分数 为__________;
为__________;
④若在相同条件下,起始时加入物质的量为:a mol CO2、b mol H2和c mol CH3OH、c mol H2O,达平衡后,CH3OH的体积分数仍为 。则a、b、c的关系为__________。
。则a、b、c的关系为__________。
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH―-4e―=O2↑+2H2O,则阴极反应式为______________________________。
-
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
(1)目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,现进行如下实验,在体积为l L的密闭容器中,充入1molCO2和3.25molH2,一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的浓度随时问变化如图所示.
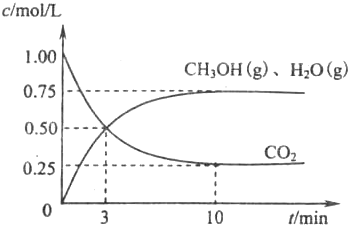
①写出该工业方法制取甲醇的化学方程式:________.
②从反应开始到平衡,氢气的平均反应速率v(H2)=________mol/.平衡时CO2的转化事为________.
③该条件下反应的平衡常数K的值为________.当温度降低时K值变大,剐该反应的△H________0(填“<”、“>”或“=”)
④下列措施中能使n(CH3OH)/n(CO2)增大的是________.
A.升高温度 B.充入He(g)
C.将H2O(g)从体系中分离 D.用更有效的催化剂
(2)在载人航天器的生态系统中.不仅要求分离除去CO2还要求提供充足的O2•某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为4OH--4e-=O2↑+2H2O.划阴极反应式为:________.
-
(17分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验,在体积为2L的密闭容器中,充入1molCO2和3.25molH2,在一定条件下发生反应,测定CO2、CH3OH和H2O(g)的浓度随时间变化如图所示:

①写出该工业方法制取甲醇的化学方程式:________。
②从反应开始到平衡,氢气的平均反应速率v(H2)=________。
③反应到达平衡后,再向该容器中通入1 mol CO2和3.25 mol H2,重新到达平衡后,H2的转化率将________(填增大、减小或不变)
④下列措施中一定能使n(CH3OH)/ n(CO2)增大的是:________。
A.向容器中充入一定量的氦气 B.充入CO2
C.将水蒸气从体系中分离 D.用更有效的催化剂
(2)可燃性的有机物和氧气在理论上都可以作为燃料电池中的反应物,请写出CH3OH —O2—KOH燃料电池的负极的电极反应式:________
(3)若将一定数量的C3H8—O2—KOH燃料电池按一定方式组成电池组以满足电解需要的电压。现用该电池组电解500mL某CuSO4的稀溶液(用铂为电极),电解后的溶液需要加入98克Cu(OH)2才能使溶液恢复到原硫酸铜溶液的浓度和质量。若忽略电池组在电解过程中的能量损失,其能量全部用来电解CuSO4溶液,则:
①原CuSO4溶液物质的量浓度________
②该电池组消耗的丙烷在标准状况时的体积________
-
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
⑴目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ/mol
CH3OH(g)+H2O(g) △H=-49.0kJ/mol
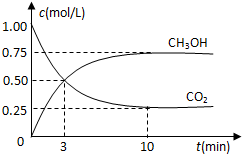
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
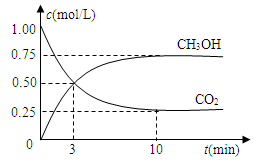
①从反应开始到平衡,氢气的平均反应速率v(H2)=___________mol/(L·min)。
②该反应的平衡常数表达式为__________________。
③下列措施中能使n(CH3OH)/n(CO2)增大的是___________。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1mol CO2和3mol H2
⑵在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2 CO2=2 CO+O2,CO可用作燃料。
已知该反应的阳极反应为:4OH――4e―=O2↑+2H2O
则阴极反应式为:________________________________。
有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染。请你判断是否可行并说出理由:__________________________________________。
-
(I)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于________。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如:
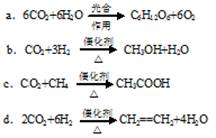
以上反应中,最节能的是________,原子利用率最高的是________。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-49.0kJ/mol
CH3OH(g)+H2O(g)△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
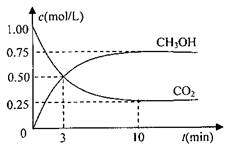
①从反应开始到平衡,氢气的平均反应速率v(H2)=________ 。
②该反应的平衡常数表达式为________,升高温度,平衡常数的数值将
________(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是________.
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2
(II)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下:
N2(g)+3H2(g)  2NH3(g) △H=-93.4kJ/mol
2NH3(g) △H=-93.4kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
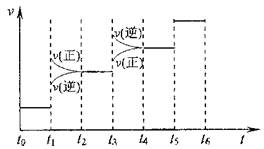
图t1时引起平衡移动的条件可能是________。
其中表示平衡混合物中NH3含量最高的一段时间是________。
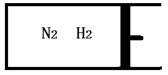
②温度为T°C时,将3amolH2和amolN2放入右图所示的密闭容器中,如果活塞能左右自由移动,充分反应后测得N2的转化率为50%。如果在相同温度下将3amolH2、amolN2和2amolNH3气体放入该容器中,平衡时H2的体积分数为________。
-
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
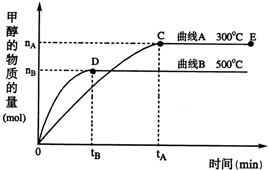
根据题意完成下列各题:反应达到平衡时,
(1)平衡常数表达式K=______,升高温度,K值______(填“增大”、“减小”或“不变”).
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=______(用 nB tB 表示)
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的 ,下列有关该体系的说法正确的是______
,下列有关该体系的说法正确的是______
a.氢气的浓度减少
b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加
d.重新平衡时 增大
增大
(4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:______(用化学方程式表示).
(5)使用燃料电池是节能减排的重要手段之一.CO和H2(俗称水煤气)燃料电池就是其中的一种,该电池的两极分别通入燃料气(水煤气)和氧气.电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.水煤气在一定条件下可以合成二甲醚,同时还产生一种可以参与大气循环的无机化合物,3CO+3H2=CH3OCH3+CO2 或 2CO+4H2=CH3OCH3+H2O.上述水煤气燃料电池的负极反应方程式:(写1个)______.
(6)如图是丙烷、二甲醚燃烧过程中能量变化图,其中x为各自反应中对应的系数.根据该图写出二甲醚燃烧的热化学方程式:______
-
(10分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中C02的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)下列关于C02的用途不正确的是________(填序号)。
A.二氧化碳能溶于水,可用于生产碳酸型饮料
B.固体二氧化碳俗称干冰,可用于人工降雨
C.二氧化碳用于灭火是因为降低了可燃物的着火点
D.超临界二氧化碳作萃取溶剂用于从天然产物提取和净化活性组分
E.二氧化碳可以作为气肥,提高农作物的产量
(2)目前工业上有一种方法是用C02来生产甲醇。为探究其反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:C02(g)+
3 H2(g)  CH30H(g)+H20(g) ΔH=-49.0kJ.m01-1,测得C02和CH3OH(g)的浓度随时间变化如图所示。
CH30H(g)+H20(g) ΔH=-49.0kJ.m01-1,测得C02和CH3OH(g)的浓度随时间变化如图所示。
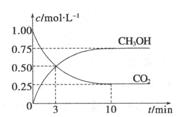
①从反应开始到平衡,氢气的平均反应速率:v(H。)=________ 。
②该反应的平衡常数为________。
(3)以KHC03溶液为电解质,用电解的方法也可以将C02还原为甲醇。请写出电解时阴极的离子方程式:________
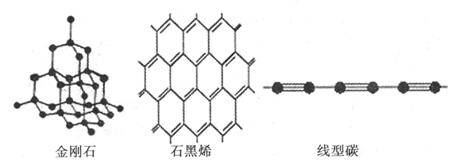
(4)金刚石、石墨烯、线型碳是碳的几种同素异形体。从键的类型分析它们的稳定性由强到弱的顺序为
-
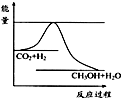
Ⅰ.由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),如右上图表示该反应进行过程中能量的变化.
CH3OH(g)+H2O(g),如右上图表示该反应进行过程中能量的变化.
(1)为探究反应原理,现进行如下实验:T1℃时,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化如右下图所示.从反应开始到平衡,用氢气浓度变化表示的平均反应速率v(H2)=________mol•L-1•min-1.
(2)该反应平衡常数K的表达式为________.
(3)温度变为T2℃(T1>T2),平衡常数K________(填“增大”、“不变”或“减小”).
(4)不能判断该反应是否达到化学平衡状态的依据是________.
A.容器中压强不变 B.混合气体中 c(CO2)不变
C.v正(H2)=v逆(H2O) D.c(CO2)=c(CO)
(5)下列措施中能使n(CH3OH)/n(CO2)增大的有________.
A.升高温度; B.加入催化剂; C.将H2O(g)从体系中分离;
D.再充入1molCO2和3molH2; E.充入He(g),使体系总压强增大.
Ⅱ.在温度t℃下,某NaOH的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12
该温度下水的离子积Kw=________;t________25℃(填“大于”、“小于”或“等于”).向该溶液中逐滴加入pH=c的盐酸(t℃),测得混合溶液的部分pH如表所示.
| 序号 | NaOH溶液的体积/mL | 盐酸的体积/mL | 溶液的pH |
| ① | 20.00 | 0.00 | 8 |
| ② | 20.00 | 20.00 | 6 |
假设溶液混合前后的体积变化忽略不计,则c为________.