-
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。
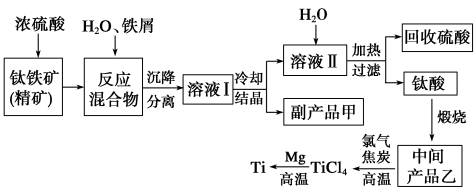
请回答下列问题。
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C===2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为______;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为_________。
(2)上述生产流程中加入铁屑的目的是___________。此时溶液中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.001 8 mol/L,当溶液的pH等于________时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为____________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为_______。Mg还原TiCl4过程中必须在1070 K的温度下进行,你认为还应该控制的反应条件是_______。除去所得金属钛中少量的金属镁可用的试剂是______。
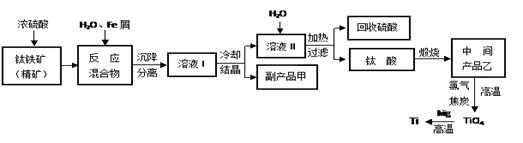
(4)在800~1 000 ℃时电解TiO2也可制得海绵钛,装置如下图所示。
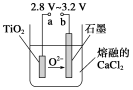
图中b是电源的________极,阴极的电极反应式为________。
-
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。
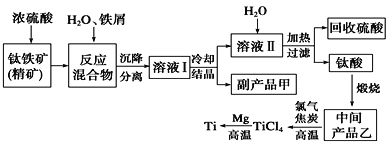
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为_____________________________________。
(2)上述生产流程中溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为______________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。
-
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。
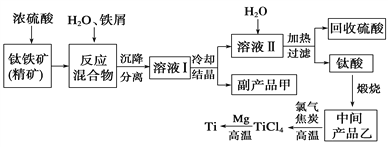
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为____________________。
(2)上述生产流程中加入铁屑的目的是_________________________,此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。除去所得金属钛中少量的金属镁可用的试剂是__________________。
-
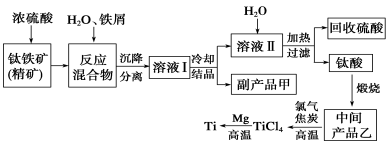
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下,回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲俗称“绿矾”其化学式是________________。
(2)上述生产流程中加入Fe屑的目的是________(用离子方程式表示),检验副产品甲是否变质的实验方法是。
(3)上述生产流程中所得到的金属钛中混有少量杂质,可加入________溶解后除去。
(4)溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当pH等于_________时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:__________________________________________________________________
(5)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应控制的反应条件是__________________________
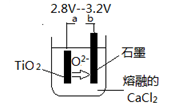
(6)在800--1000℃时电解TiO2也可制得海绵钛,装置如图所示。图中b是电源的______极,阴极的电极反应式________________。
-
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下:
回答下列问题:
(1)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲阳离子是________。
(2)上述生产流程中加入铁屑的目的是____________________________。
(3)此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
| 氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol·L-1,当溶液的pH等于________时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,写出该反应的离子方程式:________________________。
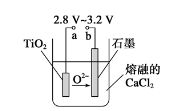
(4)Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是__________________。(5)在800~1000℃时电解TiO2也可制得海绵钛,装置如图所示。下图中b是电源的________极,阴极的电极反应式________。
-
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中。“硫酸法”生产钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质);主要生产流程如下:
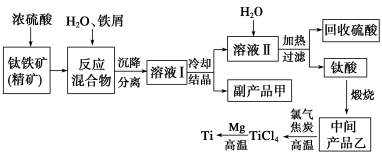
已知反应:①将钛铁矿与浓H2SO4煮【解析】
FeTiO3+2H2SO4(浓)△TiOSO4(硫酸氧钛)+FeSO4+2H2O。②加水热分解硫酸氧钛:TiOSO4+(n+1)H2O△TiO2·nH2O+H2SO4。
请回答下列问题:
(1)副产品甲是____________,可循环利用的物质是___________________________。
(2)上述生产流程中加入铁屑的目的是_______________________________________。
(3)写出中间产品乙与焦炭、氯气在高温下发生反应的方程式为:________________。
(4)“硫酸法”生产钛排放的废液对水体有哪些污染,请指出主要的两点:
①_________________________________;②_______________________________。
针对其中一项污染,提出处理的方法: 。
-
金属钛(Ti)因硬度大、熔点高、常温时耐酸碱腐蚀而被广泛应用。以钛铁矿(主要成分是FeTiO3,钛酸亚铁)为主要原料冶炼金属钛的工艺流程如图所示:

请回答下列问题:
(1)钛铁矿在酸浸前需进行粉碎处理,原因是 。
(2)钛铁矿和浓硫酸反应的产物之一是TiOSO4,反应中无气体生成。副产品甲是 。
(3)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是 。
(4)在溶液Ⅱ中加水并加热的目的是 。
(5)上述冶炼金属钛的过程中,可回收利用的物质是 。
(6)上述流程制得的金属钛中混有少量杂质,可加入 溶解除去。
(7)若钛铁矿中钛的含量为a%,整个流程钛的损耗率为b%,欲制造1 t金属钛,需要钛铁矿的质量为_____________t(用含a、b的代数式表示)。
-
金属钛(Ti)硬度大、熔点高、耐酸碱腐蚀,被广泛用于航天航空、医疗卫生及日常生活中。以钛铁矿(主要成分是FeTiO3)为原料冶炼金属钛的生产工艺如下:
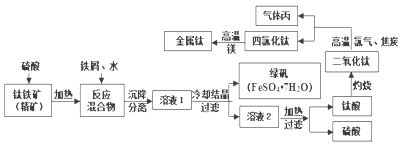
(1)钛铁矿(精矿)中加入硫酸,充分反应后生成TiOSO4、H2O和另外一种硫酸盐,且反应前后Fe的化合价不变,则FeTiO3中Fe的化合价为______。
(2)上述制备过程中,加入“铁屑”的目的是______(填字母)。
A.防Fe2+被氧化 B.与Fe3+反应 C.防Fe2+水解 D.防Fe3+水解
(3)上述生产流程中,灼烧操作需要用到的含硅酸盐的仪器有玻璃棒、酒精灯、____________。
(4)已知钛酸难溶于水,其化学式为H2TiO3。则加热溶液2时反应的离子方程式为______。
(5)已知气体丙是一种有毒气体,写出二氧化钛与氯气和过量焦炭在高温下反应的化学方程式______。
(6)铁钛合金是一种常用的不锈钢材料,某同学在探究该合金性质时,往含有TiO2+、Fe3+的溶液中加入铁屑至溶液显紫色,该过程中发生的反应有:
① 2Fe3++Fe =3Fe2+
② Ti3+(紫色)+Fe3++H2O =TiO2+(无色)+Fe2++2H+
③______。
(7)以绿矾为原料,可以制备重要工业原料氧化铁。基本流程如下:
 FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5 mol/L。请通过计算判断所得FeCO3固体中是否混有Fe(OH)2_____(已知: Ksp[Fe(OH)2] = 4.9×10-17)
FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5 mol/L。请通过计算判断所得FeCO3固体中是否混有Fe(OH)2_____(已知: Ksp[Fe(OH)2] = 4.9×10-17)
-
金属钛被称为“未来金属”,它具有硬度大,熔点高,耐腐蚀等特点。某工厂以钛铁矿(主要成分FeTiO3)为主要原料,冶炼金属Ti,其工业生产流程如图:
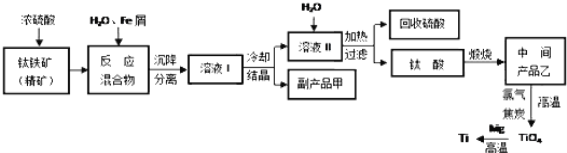
已知:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
回答下列问题:
(1)上述生产流程中加入铁屑的目的是___,检验副产品甲是否变质的实验方法是___。
(2)由溶液I获得甲晶体,需要经过___操作。除烧杯、漏斗外,过滤操作还要用到另一种玻璃仪器,该仪器在此操作中的主要作用是___。
(3)TiO2变为TiCl4的化学方程式___。但最近用熔融法直接电解中间产品乙制取金属钛获得成功,试比较用电解法生产钛比原工艺的优劣___。
(4)该工艺中消耗33.6LCl2(标况),至少可得___克甲晶体。
-
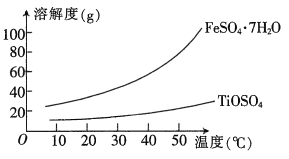
钛(T)因具有硬度大、熔点高、耐酸腐蚀等优点而被应用于航空、电子等领域,由钛铁矿(主要成分是钛酸亚铁FeTiO3)提取金属钛并获得副产品FeSO4·7H2O的工艺流程如下:

(1)钛铁矿和浓硫酸反应的产物之一是 TiOSO4。常温下,该物质易溶于酸性溶液,在pH=5.0时开始转化为钛酸沉淀,则物质A是___________(填化学式,下同),B是___________;步骤Ⅳ生成TiO(OH)2(H2TiO3)的离子方程式是______________________。
(2)已知FeSO4·7H2O和TiOSO4的溶解度曲线如图所示,则步骤Ⅲ采用的操作是___________。
(3)工业上可通过下列反应由TiO2制备金属Ti:
TiO2+2C+2Cl2 TiCi4+2CO
TiCi4+2CO
TiCl4+2Mg Ti+2MgCl2
Ti+2MgCl2
已知:常温下TiCl4是一种极易水解的无色液体,沸点为136.4℃。
①从下列供选用的装置中选择合适的装置制备TiCl4,按气流方向连接起来:A→___________→___________→___________→___________→C→___________。

②下列仪器中盛放的药品分别是B___________,G___________。
(4)一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。称取TiO2样品0.60g,消耗0.20mol/L的NH4Fe(SO4)2溶液36.75mL,则样品中TiO2的质量分数是___________。











 FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5 mol/L。请通过计算判断所得FeCO3固体中是否混有Fe(OH)2_____(已知: Ksp[Fe(OH)2] = 4.9×10-17)
FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5 mol/L。请通过计算判断所得FeCO3固体中是否混有Fe(OH)2_____(已知: Ksp[Fe(OH)2] = 4.9×10-17)


