-
(14分)
工业合成氨反应:N2+3H2 2NH3 ,在一定条件下已达到平衡状态。
2NH3 ,在一定条件下已达到平衡状态。
(1)若降低温度,会使上述平衡向生成氨的方向移动,生成每摩尔氨的反应热数值是46.2KJ/mol,则该反应的热化学方程式为________。
(2)若在恒温条件下,将N2与H2按一定比例混合的气体通入一个容积为2升固定容积的密闭容器中,5分钟后反应达平衡时,n(N2)=1.2mol, n(H2)=1.2mol, n (NH3)=0.8mol,则反应速率V(N2)=________mol·L-1·min-1,H2的转化率=________,平衡常数=________。若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡________(填向左﹑向右或不移动)移动。
(3)若在恒温恒压条件下,将1 molN2与3 molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a molNH3,这时N2的物质的量为________mol,(用含a的代数式表示);若开始时只通入N2与H2 ,达平衡时生成3amolNH3,则开始时应通入N2 3mol,H2 =________mol(平衡时NH3 的质量分数与前者相同);若开始时通入x molN2﹑6molH2 和2mol NH3,达平衡后,N2和NH3的物质的量分别为y mol和3a mol,则x=________mol,y=________mol(用含a的代数式表示)
-
工业合成氨反应:N2+3H2
 2NH3,在一定条件下已达到平衡状态.
2NH3,在一定条件下已达到平衡状态.
(1)若降低温度,会使上述平衡向生成氨的方向移动,生成每摩尔氨的反应热数值是46.2KJ/mol,则该反应的热化学方程式为______.
(2)若在恒温条件下,将N2与H2按一定比例混合的气体通入一个容积为2升固定容积的密闭容器中,5分钟后反应达平衡时,n(N2)=1.2mol,n(H2)=1.2mol,n (NH3)=0.8mol,则反应速率V(N2)=______mol•L-1•min-1,H2的转化率=______,平衡常数=______.若保持容器的温度和容积不变,将上述平衡体系中的混合气体的浓度增大1倍,则平衡______(填向左﹑向右或不移动)移动.
(3)若在恒温恒压条件下,将1molN2与3molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a molNH3,这时N2的物质的量为______mol,(用含a的代数式表示);若开始时只通入N2与H2,达平衡时生成3amolNH3,则开始时应通入N23mol,H2=______mol(平衡时NH3 的质量分数与前者相同);若开始时通入x molN2﹑6molH2 和2mol NH3,达平衡后,N2和NH3的物质的量分别为y mol和3a mol,则x=______mol,y=______mol(用含a的代数式表示)
-
工业合成氨的反应为N2+3H2⇌2NH3.设在容积为2.0L的密闭容器中充入0.6molN2和1.6molH2,反应在一定条件下达到平衡时,NH3的物质的量分数为4/7.计算:
(1)该条件下N2的平衡转化率;(保留到0.1%)
(2)该条件下反应N2+3H2⇌2NH3的平衡常数.
-
在一定条件下,合成氨反应N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,反应达到平衡后,下列说法正确的是( )
2NH3(g) ΔH=-92.4 kJ·mol-1,反应达到平衡后,下列说法正确的是( )
A. 升高温度,正反应速率加快,逆反应速率减小,平衡正向移动
B. 增大压强,平衡正向移动
C. 减小反应物浓度,平衡正向移动
D. 加入催化剂,对逆反应的反应速率影响更大,平衡正向移动
-
工业合成氨的反应为N2(g)+3H2(g) 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应经过20分钟在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应经过20分钟在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为 计算:
计算:
(1)H2在20分钟内的平均反应速率为 ;
(2)该条件下N2的平衡转化率为 ;(小数点后保留一位)
(3)该条件下反应2NH3(g) N2(g)+3H2(g)的平衡常数为 。(不带单位)
N2(g)+3H2(g)的平衡常数为 。(不带单位)
-
工业上合成氨的反应是:N2(g)+3H2(g) 2NH3(g) ΔH=-92.20 kJ·mol-1。
2NH3(g) ΔH=-92.20 kJ·mol-1。
(1)下列事实中,不能说明上述可逆反应已达到平衡的是________
①单位时间内生成2n mol NH3的同时生成3n mol H2
②单位时间内生成n mol N—H的同时生成n mol N≡N
③用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1︰3︰2
④N2、H2、NH3的体积分数不再改变
⑤混合气体的平均摩尔质量不再改变
⑥混合气体的总物质的量不再改变
(2)已知合成氨反应在某温度下2L的密闭容器中进行,测得如下数据:
| 时间(h) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| N2 | 1.50 | n1 | 1.20 | n3 | 1.00 |
| H2 | 4.50 | 4.20 | 3.60 | n4 | 3.00 |
| NH3 | 0 | 0.20 | N2 | 1.00 | 1.00 |
根据表中数据计算:
①反应进行到2小时时放出的热量为________
②0~1小时内N2的平均反应速率________ mol·L-1·h-1;
③此条件下该反应的化学平衡常数K= ________ (保留两位小数)
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00mol,化学平衡将向________ 方向移动(填“正反应”或“逆反应”、“不移动”)。
-
(14分)在一个装有可移动活塞的容器中模拟传统工业合成氨的反应:N2(g)+3H2(g)
 2NH3(g),反应达到平衡后,测得NH3的物质的量为amol
2NH3(g),反应达到平衡后,测得NH3的物质的量为amol
(1)保持容器内的温度和压强不变,向平衡体系中又通入少量的H2,再次达到平衡后,测得NH3的物质的量为bmol,则 a________b(填入“>”或“<”或“=”或“无法确定”,下同)。若向平衡体系中通入的是少量N2,则 a________b。
煤制油是一项新兴的、科技含量较高的煤化工技术,发展煤制油对我国而言具有重大意义。下列是煤通过间接液化技术制汽油和丙烯的主要工艺流程图。
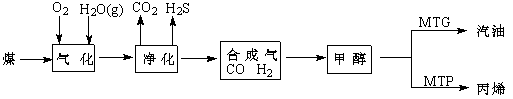
已知甲醇制烃的反应原理为:
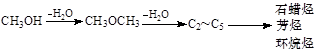
(2)为了提高原料利用率,上述工艺中应控制合成气中V(CO):V(H2)= ________。
(3)由二甲醚在催化剂作用下转化为丙烯的化学方程式为: 。
(4)每生产1t甲醇约耗煤1.5t,每生产1 t汽油约需耗2.4t甲醇,2015年我国煤制油将达到1000万吨,则2015年当年需消耗原煤约 万吨。
(5)采用MTG法生产的汽油中,均四甲苯(1,2,4,5-四甲基苯)质量分数约占4 %~7%,均四甲苯的结构简式为: 。
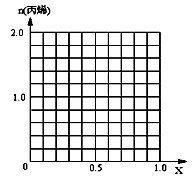
(6)采用DMTO技术,若获得乙烯和丙烯及丁烯3种烃,生成丁烯的选择性(转化丁烯的甲醇的物质的量与甲醇总物质的量之比)为20%,其余生成乙烯和丙烯,设丙烯的选择性为x,今有403.2L(标准状况)合成气,且完全转化为甲醇,甲醇转化为烯烃的总转化率亦为100%,请作出丙烯的物质的量随x变化的曲线。
-
工业合成氨的反应为:N2(g)+3H2(g)⇌2NH3(g),正反应是放热反应,下列有关说法正确的是( )
A.增大压强N2、H2的转化率均增大
B.降低温度,混合气体的密度减小
C.使用催化剂有利于平衡向正反应方向移动
D.升高温度既可提高反应速度,又可以提高NH3在平衡混合气体中的含量
-
25 ℃时,合成氨反应的热化学方程式为:N2 (g) +3H2 (g)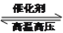 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
下列叙述正确的是
A. 混合气体的质量不变时,说明该反应一定达到平衡状态
B. 将容器的体积扩大到原来的二倍,υ(正)减小,υ(逆)增大,平衡向左移动
C. 催化剂既能提高N2的转化率,又能缩短达到平衡所需时间,提高生产效益
D. 在密闭容器中放入1 mol N2和3 mol H2进行反应,测得反应放出的热量小于92.4 kJ
-
25 ℃时,合成氨反应的热化学方程式为:
N2 (g) +3H2 (g)  2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
下列叙述正确的是
A.混合气体的质量不变时,说明该反应一定达到平衡状态
B.将容器的体积扩大到原来的二倍,υ(正)减小,υ(逆)增大,平衡向左移动
C.催化剂既能提高N2的转化率,又能缩短达到平衡所需时间,提高生产效益
D.在密闭容器中放入1 mol N2和3 mol H2进行反应,测得反应放出的热量小于92.4 kJ
2NH3 ,在一定条件下已达到平衡状态。

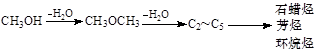

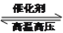 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol