-
Ⅰ.高锰酸钾是锰的重要化合物和常用氧化剂,在实验室和医疗上有非常广泛的应用。如图1是工业上用软锰矿(主要含MnO2)制备高锰酸钾晶体的一种工艺流程:
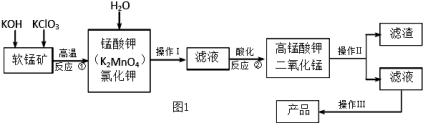
(1)第①步加热熔融应在铁坩埚中进行,而不用瓷坩埚的原因是(用化学方程式表示)。写出反应①的离子方程式;
(2)反应②的产物中,氧化产物与还原产物的物质的量的比是
(3)反应②中“酸化”时应选择下列酸中的(填序号)
a.稀盐酸b.稀硫酸c.亚硫酸
(4)操作Ⅱ的名称是,实验室进行该操作需用到的玻璃仪器有
Ⅱ.某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究SO2和Cl2的性质
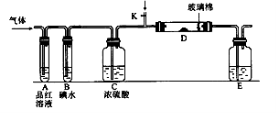
(5)若从左端分别通入SO2和Cl2,装置A中观察到的现象是否相同?(填“相同”或“不相同”)。
(6)若装置B中装有5.0mL1.0mol/L的碘水,当通入足量C l2完全反应后,共转移了5.0×10-2mol电子,该反应的化学方程式为;
l2完全反应后,共转移了5.0×10-2mol电子,该反应的化学方程式为;
(7)若由元素S和O组成-2价酸根离子X,X中S和O的质量比为4∶3。当Cl2与含X的溶液完全反应后,有浅黄色沉淀产生,取少量上层清加入盐酸酸化的氯化钡溶液,有白色沉淀产生。写出Cl2与含X的溶液反应的离子方程式。
-
高锰酸钾是锰的重要化合物和常用氧化剂,在实验室和医疗上有非常广泛的应用。以下是工业上用软锰矿(主要含MnO2)制备高锰酸钾晶体的一种工艺流程:
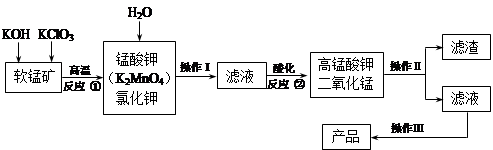
(1)操作Ⅱ的名称是_______,实验室进行该操作须用到的玻璃仪器有 ;
(2)反应②的产物中,氧化产物与还原产物的物质的 量之比是______;
(3)反应②中“酸化”时不能选择下列酸中的______(填字母序号)
a.稀盐酸 b.稀硫酸 c.稀醋酸
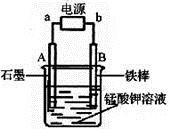
(4)电解锰酸钾溶液也可以制备高锰酸钾,其阴极反应式为:2H2O + 2e-= 2OH-+ H2↑,如图,b为电源的_______极,电解池的阳极反应式是_______;若电解过程中收集到2.24 L H2(标准状况),则得到高锰酸钾______g。(提示:阴离子放电顺序MnO42->OH-)
-
高锰酸钾是锰的重要化合物和常用的氧化剂。以下是实验室中模拟工业上用软锰矿制备高锰酸钾的流程图。
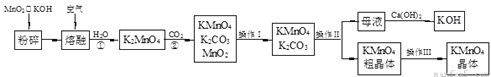
(1)操作Ⅰ的名称为_________。
(2)反应②的化学方程式为____________。工业上用上述原理生产KMnO4方法产率较低,较好的制备方法是电解法。用Pt作阳极,Fe作阴极,K2MnO4为电解液,阳极的电极反应式为_________________。
(3)KMnO4在酸性介质中的强氧化性广泛应用于分析化学中。
例如:2KMnO4+3H2SO4+5Na2SO3=5Na2SO4+K2SO4+2MnSO4+3H2O。某同学用KMnO4测定实验室长期存放的Na2SO3固体的纯度。现欲准确称取6.3 g Na2SO3固体样品,配成500 mL溶液。取25.00 mL上述溶液放入锥形瓶中,用0.01000 mol/L 的酸性KMnO4溶液进行滴定。滴定结果如下表所示: 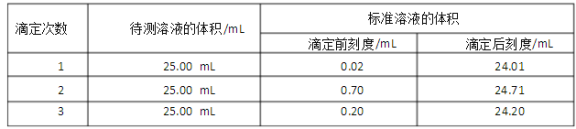
配制500 mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙和_____、____。
②判断滴定终点的依据是____________________________________________。
③下列操作会导致测定结果偏高的是___________。
A.未用标准浓度的酸性KMnO4溶液润洗滴定管 B.滴定前锥形瓶未干燥
C.滴定前滴定管尖嘴部分有气泡 D.观察读数时,滴定前仰视,滴定后俯视
④用上述实验数据,计算Na2SO3的纯度为______________。(保留三位有效数字)
-
(19分)高锰酸钾是锰的重要化合物和常用的氧化剂。以下是实验室中模拟工业上用软锰矿制备高锰酸钾的流程图。

(1)操作Ⅰ的名称为________;操作Ⅲ的名称为________。
(2)反应②的化学方程式为 ________。工业上用上述原理生产KMnO4方法产率较低,较好的制备方法是电解法。用Pt作阳极,Fe作阴极,K2MnO4为电解液,阳极的电极反应式为________。
(3)KMnO4是一种较稳定的化合物,但日光对KMnO4溶液的分解有催化作用,生成MnO2、KOH和O2。而 MnO2也是该分解反应的一种催化剂,请你设计一个实验方案,验证MnO2对该分解反应具有催化性:________。
(4)KMnO4在酸性介质中的强氧化性广泛应用于分析化学中。
例如:2KMnO4+3H2SO4+5Na2SO35Na2SO4+K2SO4+2MnSO4+3H2O。某同学用KMnO4测定实验室长期存放的Na2SO3固体的纯度。现欲准确称取6.3 g Na2SO3固体样品,配成500 mL溶液。取25.00 mL上述溶液放入锥形瓶中,用0.01000 mol/L 的酸性KMnO4溶液进行滴定。滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 |
| 滴定前刻度/mL | 滴定后刻度/mL |
| 1 | 25.00 mL | 0.02 | 24.01 |
| 2 | 25.00 mL | 0.70 | 24.71 |
| 3 | 25.00 mL | 0.20 | 24.20 |
①配制500 mLNa2SO3溶液时,必须用到的实验仪器有:烧杯、玻璃棒、胶头滴管、药匙和________、________。
②判断滴定终点的依据是________。
③下列操作会导致测定结果偏高的是________
A.未用标准浓度的酸性KMnO4溶液润洗滴定管
B.滴定前锥形瓶未干燥
C.滴定前滴定管尖嘴部分有气泡
D.观察读数时,滴定前仰视,滴定后俯视
④用上述实验数据,计算Na2SO3的纯度为________。
-
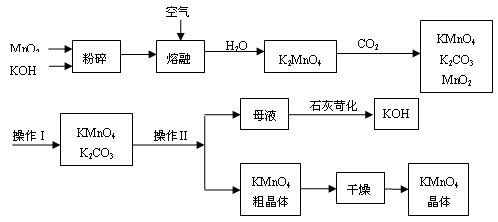
(13分)工业制备高锰酸钾是锰的重要化合物和常用的氧化剂。以下是工业上用软锰矿制备高锰酸钾的一种工艺流程。
①KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是______(填代号)。
a、84消毒液(NaClO溶液) b、双氧水 c、苯酚 d、75%酒精
②高锰酸钾保存在棕色试剂瓶,下列试剂保存不需要棕色试剂瓶的是_______(填代号)。
a、浓硝酸 b、 硝酸银 c、氯水 d、烧碱
③上述流程中可以循环使用的物质有________、________(写化学式)。
④若不考虑物质循环与制备过程中的损失,则1 mol MnO2可制得 mol KMnO4。
⑤该生产中需要纯净的CO2气体。若实验室要制备纯净的CO2,所需试剂最好选择(选填代号)________。a、石灰石 b、稀HCl c、稀H2SO4 d、纯碱
⑥操作Ⅰ的名称是________;操作Ⅱ根据KMnO4和K2CO3两物质在________(填性质)上的差异,采用________(填操作步骤)、趁热过滤得到KMnO4粗晶体。
-
三氧化二锰(Mn2O3)在现代工业上应用广泛,在锂离子电池的制备中有重要的作用。用软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)制备高纯度Mn2O3的工艺流程如图所示。
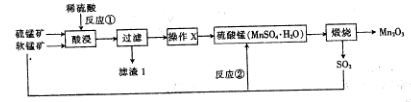
(1)反应①中会生成一种非金属单质,则该非金属单质是_________________,该反应的还原剂是________________。(填化学式)
(2)操作X为蒸发浓缩、__________、过滤、洗涤烘干。在洗涤操作中,常用酒精洗涤MnSO4·H2O晶体,主要目的是________________;
(3)Mn2O3与MnO2类似,加热时也能与浓盐酸反应放出Cl2,该反应的离子方程式为_____________;
-
高锰酸钾是常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。中间产物为锰酸钾。下图是实验室模拟制备KMnO4晶体的操作流程:
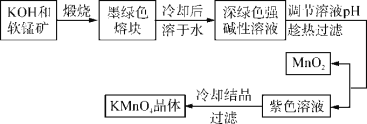
已知:锰酸钾(K2MnO4)是墨绿色晶体,其水溶液呈深绿色,这是锰酸根离子(MnO )在水溶液中的特征颜色,在强碱性溶液中能稳定存在;在酸性、中性和弱碱性环境下,MnO
)在水溶液中的特征颜色,在强碱性溶液中能稳定存在;在酸性、中性和弱碱性环境下,MnO 会发生自身氧化还原反应,生成MnO
会发生自身氧化还原反应,生成MnO 和MnO2。
和MnO2。
回答下列问题:
(1)KOH的电子式为____________。
(2)调节溶液pH过程中,所得氧化产物与还原产物的物质的量之比为____________。
(3)趁热过滤的目的是_____________________________________________。
(4)已知20 ℃时K2SO4、KCl、CH3COOK的溶解度分别为11.1 g、34 g、217 g,则从理论上分析,选用下列酸中________(填标号),得到的高锰酸钾晶体纯度更高。
A.稀硫酸 B.浓盐酸 C.醋酸 D.稀盐酸
(5)产品中KMnO4的定量
①配制浓度为0.1250 mg· mL-1的KMnO4标准溶液100 mL。
②将上述溶液稀释为浓度分别为2.5、5.0、7.5、10.0、12.5、15.0(单位:mg·L-1)的溶液,分别测定不同浓度溶液对光的吸收程度,并将测定结果绘制成曲线如下。
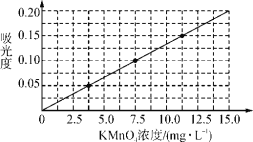
③称取KMnO4样品(不含K2MnO4)0.1250 g按步骤①配得产品溶液1000 mL,取10 mL稀释至100 mL,然后按步骤②的方法进行测定,两次测定所得的吸光度分别为0.149、0.151,则样品中KMnO4的质量分数为________。
(6)酸性KMnO4溶液与FeSO4溶液反应的离子方程式为____________________。
-
三氧化二猛(Mn2O3)在现代工业上应用广泛。以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料制备高纯度硫酸锰进而制备三氧化二锰的工艺流程如下(两种矿物中均不存在单质杂质):
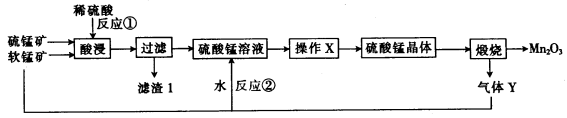
(1)滤渣1中存在一种非金属单质,则“酸浸”时反应①的化学方程式为___________。
(2)操作X为蒸发浓缩、_____________、洗涤烘干。经操作X之后得到MnSO4 • H2O。在洗涤操作中,常用酒精洗涤MnSO4 • H2O晶体,主要目的是_________________。
(3) 气体Y直接排放会污染空气,将Y的水溶液与软锰矿反应可得硫酸锰,反应②的化学方程式为____________。
(4) Mn2O3与MnO2类似,也能与浓盐酸反应,其反应的离子方程式为___________。
(5)用标准的BaCl2溶液测定样品中MnSO4 • H2O的质量分数时,发现样品纯度大于100%(测定过程中产生的误差可忽略),其原因可能是__________(任写一点)。
-
软锰矿的主要成分是MnO2,还含有少量金属铁、镁、铝、锌、铜的化合物等杂质。黄铁矿的主要成分是FeS2,还含有硅、铝的氧化物等杂质。工业上用软锰矿制备碳酸锰并回收硫酸铵,其主要流程如下:
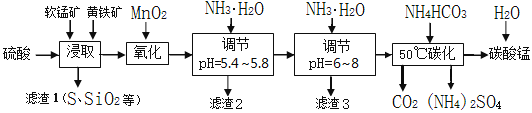
已知金属离子从开始形成氢氧化物沉淀,到沉淀时溶液的pH如下表:
| 金属离子 | Fe2+ | Fe3+ | Al3+ | Cu2+ | Mn2+ |
| 开始沉淀pH | 7.5 | 2.7 | 4.1 | 5.9 | 8.8 |
| 完全沉淀pH | 9.5 | 3.7 | 5.4 | 6.9 | 10.8 |
(1)提高浸出率的可采取的措施有_________。
A.适当升高温度 B.搅拌 C.加适量纯碱 D.加压
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,则浸取时发生的主要反应的化学方程式是____________________________________________。
(3)调节pH为5.4~5.8的目的是_____________________________________________。
(4)滤渣3的主要成分的化学式是_____________。
(5)50℃碳化过程发生反应的离子方程式是____________________________________。
-
三氧化二锰(Mn2O3)在现代工业上位用广泛,在锂离子电池的制备中有重要的作用。 用软锰矿 (主要成分为MnO2)和硫锰矿(主要成分为MnS)制备高纯度Mn2O3的工艺流程如图所示。
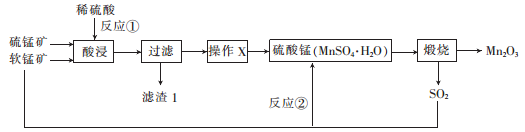
(1) 反应①中会生成一种非金属单质,则该非金属单质是___________,该反应的还原剂是__________。(填化学式)
(2) 操作X为蒸发浓缩、_____________、过滤、洗涤烘干。在洗涤操作中,常用酒精洗涤MnSO4 •H2O晶体,主要目的是______________。
(3) Mn2O3与MnO2类似,加热时也能与浓盐酸反应放出Cl2,该反应的离子方程式为__________。


l2完全反应后,共转移了5.0×10-2mol电子,该反应的化学方程式为;











