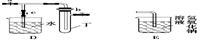-
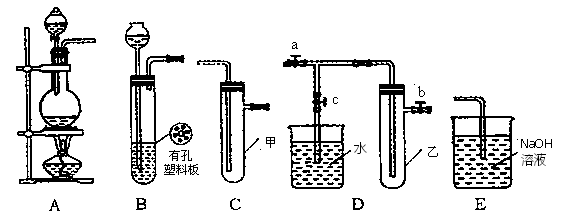
(Ⅰ)某化学兴趣小组的同学得上用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
(1)请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱。
①选择合理的装置连接:________→________→________(填字母编号)。
②选择所需的试剂:________(填字母编号)。
a.固体氯化钠 b.固体二氧化锰 c.浓硫酸
d.浓盐酸 e.稀盐酸 f.溴化钠溶液
③实验现象及结论:________。
(Ⅱ)电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害,某兴趣小组对该电池电极材料进行资源回收并制备NiSO4·7H2O晶体,设计实验流程如下:
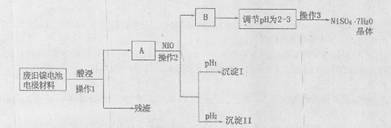
已知:①NiSO4易溶于水,Fe3+不能氧化Ni2+
②某温度下一些金属氢氧化物的KSP及析出理论pH如下表所示:
| M(OH)n | Ksp | pH |
| 开始沉淀 | 沉淀完全 |
| Al(OH)3 | 1.9×10-23 | 3.43 | 4.19 |
| Fe(OH)3 | 3.8×10-38 | 2.53 | 2.94 |
| Ni(OH)2 | 1.6×10-14 | 7.60 | 9.75 |
回答下列问题:
(1)根据上表数据判断操作2依次析出的沉淀I是________沉淀II是(填化学式),pH1________pH2(填“>”、“<”或“=”);
(2)操作1和操作2所用到的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为________。
(3)“调节pH为2-3”的目的是________;
(4)NiSO4在强碱溶溶中用NaClO氧化,可制得碱性镍镉电池电极材料——NiOOH。该反应的离子方程式是________。
-
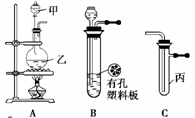
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
(1)请利用上述装置设计一个简单的实验验证Cl—和Br—的还原性强弱。
①选择合理的装置连接:________→________→________。(填字母编号)
②从下列提供的试剂选择你所需的试剂:________。(填字母编号)
a. 固体氯化钠 b. 固体二氧化锰 c. 浓硫酸
d. 浓盐酸 e. 稀盐酸 f. 溴化钠溶液
③实验现象及结论:________。
(2)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验,其操作步骤为
①先关闭止水夹________,再打开止水夹________,使NO2充满试管乙。接着关闭止水夹________,打开止水夹________,最后微热试管乙,使烧杯中的水倒流进入试管乙。
②试管乙中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管 全部充满水,则所得溶液中溶质的物质的量浓度是________(气体按标准状况计算)。
-
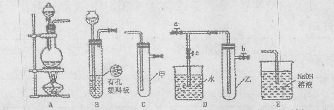
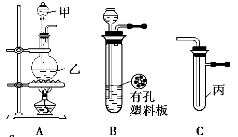
(18分)某化学兴趣小组的同学利用下图所示实验装置进行实验。(图中a、b、c表示止水夹)。

请按要求填空:
(1)利用B装置可制取的气体有 (至少填2种),写出实验室里利用A装置制取氯气的离子方程式 。
(2)只用A、C、E相连后的装置用于制取Cl2并进行相关的性质实验。若在丙中加入适量水,即可制得氯水。将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
| 实验序号 | 实验操作 | 现 象 | 结 论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
①请评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由。 (任选1个实验进行评价。)
②若要利用上述A、C装置设计一个简单的实验,验证Cl2和I2的氧化性强弱,可以在甲、乙、丙中分别装入浓盐酸、MnO2、淀粉碘化钾溶液,根据丙中产生的现象是 ,则可证明Cl2的氧化性强于I2 。
(3)B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
①B中发生反应的化学方程式 。
② 欲用D装置验证NO2与水的反应,其操作步骤:先关闭止水夹 (填写a、b或c),再打开止水夹 (填写a、b或c),若要使D烧杯中的水进入试管丁的操作是:通过 试管丁,使试管丁的NO2气体逸出,NO2与水接触后即可引发烧杯中的水倒流进入试管丁。
-
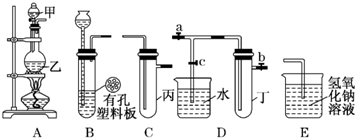
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹).
请按要求填空:
(1)实验室利用B装置可制取的气体有______(填化学式,写出两种即可).
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验.
①若在丙中加入适量水,即可制得氯水.将所得氯水分为两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象、结论如下:
实验
序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气
泡产生 | 氯气与水反应的产物具有酸性 |
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由______.
②请利用上述装置设计一个简单的实验验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛放的试剂、实验现象及结论)______.
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得并进行NO2有关实验.
①B中发生反应的化学方程式为______.
②欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹______,再打开止水夹______,使烧杯中的水进入试管丁的操作是______.
-
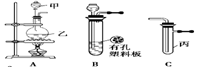
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。

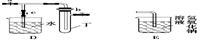
请按要求填空:
(1)利用B装置可制取的气体有(填2种)。
A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
若在丙中加入适量水,即可制得氯水。将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
(2)请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由。________
________。
(3)请利用上述A、C装置设计一个简单的实验,验证Cl2和Br2的氧化性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)
________。
B、D、E装置相连后,在B中盛装足量浓硝酸和铜片(放在有孔塑料板上),可制得NO2并进行有关实验。
(4)B中发生反应的化学方程式为________。
(5)欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹________,再打开止水夹________,使烧杯中的水进入试管丁的操作是________
________。
(6)试管丁中的NO2与一定量的O2混合后倒插水中,试管9/10充满水,则原试管丁中的混合气体的平均分子量可能为________。(保留二位小数)
-
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
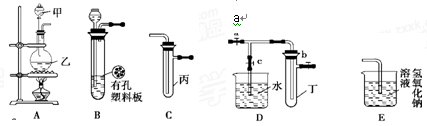
请按要求填空:
(1)利用B装置可制取的气体有________。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
①若在丙中加入适量水,即可制得氯水。将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由。________
________。
②请利用上述装置设计一个简单的实验,验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)________
。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2
并进行有关实验。
① B中发生反应的化学方程式为________。
② 欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹________,再打开止水夹________,使烧杯中的水进入试管丁的操作是________。
③ 试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是________(气体按标准状况计算)。
-
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。

请按要求填空:
(1)利用B装置可制取的气体有________。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
① 若在丙中加入适量水,即可制得氯水。将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由。________
。
② 请利用上述装置设计一个简单的实验,验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)________
。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2
并进行有关实验。
① B中发生反应的化学方程式为。
② 欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹________,再打开止水夹________,使烧杯中的水进入试管丁的操作是。
③ 试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是________(气体按标准状况计算)。
-
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
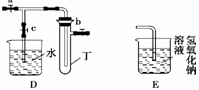
请按要求填空:
(1)利用B装置可制取的气体有________。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
① 若在丙中加入适量水,即可制得氯水。将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入 NaHCO3粉末 | 有无色气泡产生 | 氯气与水反应的产物具有较强的酸性 |
请你评价实验Ⅰ、Ⅱ的结论是否合理?若不合理,请说明理由。________
。
② 请利用上述装置设计一个简单的实验,验证Cl-和Br-的还原性强弱(分别指出甲、乙、丙中盛装的试剂、实验现象及结论)________
。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得NO2
并进行有关实验。
① B中发生反应的化学方程式为。
② 欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹________,再打开止水夹________,使烧杯中的水进入试管丁的操作是。
③ 试管丁中的NO2与水充分反应后,若向试管内缓缓通入一定量的O2,直至试管全部充满水,则所得溶液中溶质的物质的量浓度是________(气体按标准状况计算)。
-
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹) 。
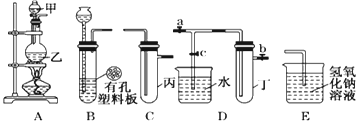
(1)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。①若在丙中加入适量水,即可制得氯水。将所得氯水进行实验,实验操作、现象、结论如下:
| 实验操作 | 现 象 | 结 论 |
| 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气和水反应的产物具有酸性 |
实验的结论是否合理__________,(选填合理或不合理)请说明理由______________________。请利用上述装置设计一个简单的实验验证Cl-和S2-的还原性强弱,则甲、乙、丙中盛放的试剂是甲__________________ 乙__________________ 丙__________________
(2)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),可制得并进行NO2有关实验。欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹________,再打开止水夹________,使烧杯中的水进入试管丁的操作是:___________________________________使试管中的气体逸出,NO2与水接触后即可引发烧杯中的水进入试管丁。
-
某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。
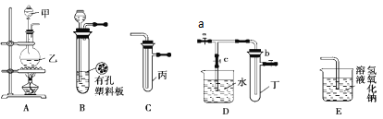
请按要求填空:
(1)A装置中甲仪器名称为______。
(2)A、C、E相连后的装置可用于制取Cl2并进行相关的性质实验。
① A中乙为MnO2固体,甲中盛有浓盐酸,则烧瓶中发生反应的化学方程式为_____________。
② 若在丙中加入适量水,即可制得氯水。将所得氯水分成两份,进行Ⅰ、Ⅱ两个实验,实验操作、现象结论如下:
Ⅰ. 将氯水滴入品红溶液中,现象________________。
Ⅱ. 氯水中加入 NaHCO3粉末,有无色气泡产生,某同学得出结论:氯气与水反应的产物具有较强的酸性。请你评价该同学的结论是否合理?若不合理,请说明理由。 ___________________
③E装置的作用__________________。
(3)B、D、E装置相连后,在B中盛装浓硝酸和铜片(放在有孔塑料板上),关闭止水夹c,制得NO2,接着再进行有关实验。
① 欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹_____,再打开止水夹_____,使烧杯中的水进入试管丁的操作是_________________。
② NO2尾气可用NaOH溶液吸收生成两种钠盐,写出反应的化学方程式为____________。