-
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。
(1) 500℃、50MPa时,在容积为5L的密闭容器中加入4 mol N2、8 mol H2,反应达平衡时N2的转化率为25%,该反应的平衡常数为K,则K=__________________。
(2) 500℃、50MPa时,在容积为5L的密闭容器中,按下列配比作为起始物质,达到平衡后N2的转化率仍为25%的是_____________
A.2molN2+4molH2 B.2molN2+4molH2+ 6molHe
C.4molN2+8molH2+6molHe D.3molN2+5molH2+2molNH3
(3)希腊阿里斯多德大学的 George Marnellos 和 Michael Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池,利用能通过氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,试写出电解池阴极的电极反应式 ________ 。
(4)合成氨工厂常通过测定反应前后混合气体的密度来确定N2的转化率。某工厂测得反应前合成塔中N2和H2混合气体的密度为0.554g·L-1,从合成塔出来的混合气体在相同条件下密度为0.693g·L-1(密度均在标准状况下测定),则该合成氨厂N2的转化率_____________。
-
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.利用N2和H2合成氨,目前工业的生产条件为:催化剂(铁触媒),温度(400~500℃),压强(30~50MPa),如图为流程示意图:
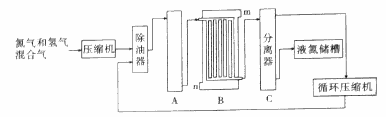
请回答下列问题:
(1)工业合成氨的原料是氮气和氢气.氮气是从空气中分离出来的,通常使用的两种分离方法是__________,__________;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式__________,__________;
(2)设备A中含有电加热器、铁触煤和热交换器,设备A的名称__________,其中发生的化学反应方程式为__________;实际生产中采用400~500℃的高温,原因之一是__________,原因之二是__________。
(3)设备B的名称__________,其中m和n是两个通水口,入水口是__________(填“m”或“n”).不宜从相反方向通水的原因是__________;
(4)设备C的作用__________;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g) CO2 (g)+H2 (g),已知1000K时该反应的平衡常数K=1,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于__________。
CO2 (g)+H2 (g),已知1000K时该反应的平衡常数K=1,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于__________。
-
(本题12分)
氮是地球上含量丰富的一种元素,合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重要影响。铵盐在工农业生产、生活中有着重大作用。
 完成下列填空
完成下列填空
(1).在固定体积的密闭容器中,进行如下放热反应:N2(g)+3H2(g) 2NH3(g),其平衡常数K与温度T的关系如下表。
| T/K | 298 | 398 | 498 | …… |
| 平衡常数K | 4.1×106 | K1 | K2 | …… |
则该反应的平衡常数K1________K2 (填“>”、“<”或“=”)。
(2).能说明该反应已达到平衡状态的是________(填序号)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。
请回答下列问题:
(3).相同条件下,0.1 mol·L-1 NH4Al(SO4)2中c(NH4+)________(填“等于”“大于”或“小于”)0.1 mol·L-1 NH4HSO4中的c(NH4+)。
(4).如图所示是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
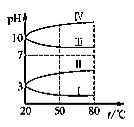
①其中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________(填写序号),
导致pH随温度变化的原因是_______________________________;
②20℃时,0.1 mol·L-1 NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=__________。
(5).室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示。
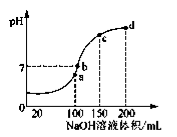
试分析图中a、b、c、d四个点,水的电离程度最大是________点;在b点,溶液中各离子浓度由大到小的排列顺序是______________。
-
(12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g)  2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是________。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是________。
(2)500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K=________。
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部
分物质的燃烧热数据如下表:
| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O(g)在高温下反应的热化学方程式________。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。请写出该电池的正极反应式________。
-
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:N2(g)+3H2(g)
 2(((NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.
2(((NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.

(1)在一容积固定的密闭容器中注入N2和H2两种气体,发生上述反应.在某温度下达到平衡时各物质的浓度分别为c(H2)=9.00mol/L,c(N2)=3.00mol/L,c(NH3)=4.00mol/L,此温度下该反应的平衡常数为______.
(2)三个相同容器中各充入1molN2和3molH2,在不同条件下反应并达到平衡,氨的体积分数随时间的变化如图所示.下列说法正确的是______(填序号).
A.图I可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ一定是在同温同压下不同催化剂对反应的影响,且催化剂效果1>2
(3)将水蒸气通过红热的炭即产生水蒸气,化学方程式为:C(s)+H2O(g) H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K该反应在低温下能否自发______(填:能或否).
H2(g)+CO(g)△H=+131.3kJ,△S=+133.7J/K该反应在低温下能否自发______(填:能或否).
(4)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g).部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热 |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0kJ热量.写出CH4和H2O在高温下反应的热化学方程式______.
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池.请写出该电池的正极反应式______.
-
(12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) 3NH3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
3NH3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
(1) 合成氨工业中原料气压缩到30~50MPa的原因是________。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是________。
(2) 500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K1,此时N2的转化率为x。则K1和x的关系满足K1=________。若温度为400℃,平衡常数为K2,则K1________K2(填“<”、“=”或“>” )
(3) 甲烷在高温下与水蒸气反应的热化学反应方程式为:
CH4(g)+H2O(g)=CO(g)+3H2(g); △H kJ·mol-1。
又已知: H2(g) +1/2 O2(g)== H2O(l); △H1=-285.8kJ/mol
CO(g) + 1/2 O2(g)=CO2(g) ;△H2=-283.0kJ/mol
CH4(g) +2 O2(g)== CO2(g) + 2H2O(l); △H3=-890.3kJ/mol
H2O(g) == H2O(l); △H4=-44.0kJ/mol
①写出H2(g)完全燃烧生成气态水的热化学方程式。
② CH4(g)+H2O(g)=CO(g)+3H2(g); △H=kJ/mol
-
(12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) 2NH3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
2NH3(g) ,△H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是________。从平
衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,
原因之一是考虑到催化剂的催化活性,原因之二是________。
(2)500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后
测得平衡常数为K1,此时N2的转化率为x。则K1和x的关系满足K1=________。
若温度为400℃,平衡常数为K2,则K1________K2(填“<”、“=”或“>” )
(3)甲烷在高温下与水蒸气反应的热化学反应方程式为:
CH4(g)+H2O(g)=CO(g)+3H2(g);△H kJ·mol-1。
又已知: H2(g) +1/2 O2(g)== H2O(l);△H1=-285.8kJ/mol
CO(g) + 1/2 O2(g)=CO2(g);△H2=-283.0kJ/mol
CH4(g) +2 O2(g)== CO2(g)+ 2H2O(l);△H3=-890.3kJ/mol
H2O(g)== H2O(l); △H4=-44.0kJ/mol
①写出H2(g)完全燃烧生成气态水的热化学方程式。
②CH4(g)+H2O(g)=CO(g)+3H2(g); △H=kJ/mol
-
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:N2(g)+3H2(g)⇌3NH3(g),△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa.回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是______.从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是______.
(2)500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K1,此时N2的转化率为x.则K和x的关系满足K=______.若温度为400℃,平衡常数为K2,则K1______K2(填“<”、“=”或“>”)
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g).部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热 |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0kJ热量.
①写出CO燃烧的热化学方程式______.
②2H2(g)+O2(g)═2H2O(g)△H=______kJ/mol.
-
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得。
2NH3(g) ΔH=-92.2 kJ·mol-1。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得。
(1)在一容积固定的密闭容器中注入N2和H2两种气体,发生上述反应,在某温度下达到平衡时,各物质的浓度分别是:c(H2)=9.00 mol·L-1,c(N2)=3.00 mol·L-1,c(NH3)=4.00 mol·L-1,此温度下该反应的平衡常数K=________。
(2)在三个相同容器中各充入1 mol N2和3 mol H2,在不同条件下反应并达到平衡,氨的体积分数随时间变化的曲线如图所示。下列说法中正确的是________(填字母)。
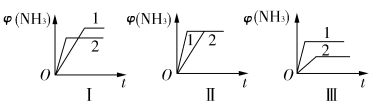
A.图Ⅰ可能是不同压强对反应的影响,且p2>p1
B.图Ⅱ可能是不同压强对反应的影响,且p1>p2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
(3)将水蒸气通过红热的炭即可产生水煤气,化学方程式为:C(s)+H2O(g)=H2(g)+CO(g)
ΔH=+131.3 kJ·mol-1,ΔS=+133.7J·K-1 ·mol-1
该反应在常温下能否自发进行?________(填“能”或“不能”)。
-
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响.合成氨反应的化学方程式为:N2(g)+3H2(g)
 3NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa.
3NH3(g)△H=-92.2kJ/mol.合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得.我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa.
回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是______.从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是______.
(2)500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x.则K和x的关系满足K=______.
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g).部分物质的燃烧热数据如下表:
| 物 质 | 燃烧热 |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0kJ热量.写出CH4和H2O在高温下反应的热化学方程式______.
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池.请写出该电池的正极反应式______.




