-
Ⅰ.氢气是重要的化学试剂、化工原料和有广阔发展前景的新能源。以甲醇为原料制备氢气的一种原理如下:
i. CH3OH(g)  CO(g)+ 2H2(g) △H =+90kJ·mol-1
CO(g)+ 2H2(g) △H =+90kJ·mol-1
ii. CO(g)+H2O(g) CO2(g)+ H2(g) △H =-41kJ·mol-1
CO2(g)+ H2(g) △H =-41kJ·mol-1
(1)向VL 恒容密闭容器中充入lmol CH3OH(g),发生反应i。图I中能正确表示CHOH(g)的平衡转化率(a)随温度(T) 变化关系的曲线为_______________(填“A”或“B”)。T1℃时,体系的平衡压强与起始压强之比为_________________________。
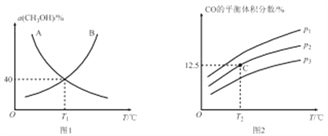
(2)起始向10L 恒容密闭容器中充入lmol CH3OH(g)和1molH2O(g),发生反应i和反应ii,体系中CO的平衡体积分数与温度(T)和压强(P)的关系如图2所示。
①P1、P2、P3由大到小的顺序为___________________。
②测得C点时、体系中CO2的物质的量为0.2mol,则T2℃时,反应ii 的平衡常数K=________。
Ⅱ.现有HA、HB 和H2C三种酸。室温下用0.1mol·L-1NaOH溶液分别滴定20.00 mL浓度均为0.1mol·L-1的HA、HB两种酸的溶液,滴定过程中溶液的pH随滴入的NaOH 溶液体积的变化如图所示。
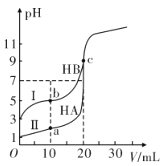
(1)a点时的溶液中由水电离出的c(H+)=________mol·L-1。
(2)与曲线I 上的c点对应的溶液中各离子浓度由大到小的顺序为_____________________________;
(3)已知常温下向0.1mol·L-1的NaHC 溶液中滴入几滴石蕊试液后溶液变成红色。
① 若测得此溶液的pH=1,则NaHC的电离方程式为_______________。
②若在此溶液中能检测到H2C 分子,则此溶液中c(C2-)________c(H2C)(填“>”“<”或“=”)。
③若H2C 的一级电离为H2C=H++ HC-,常温下0.1mol·L-1H2C溶液中的c(H+ )=0.11mol·L-1,则0.1mol·L-1NaHC溶液中的c(H+)________0.01mol·L-1(填“>”“<”或“=”)。
-
氢气是重要的化学试剂、化工原料和有广阔发展前景的新能源。以甲醇为原料制备氢气的一种原理如下:
i.CH3OH(g)  CO(g)+ 2H2 △H =+90kJ·mol-1
CO(g)+ 2H2 △H =+90kJ·mol-1
ii.CO(g)+H2O(g) CO2(g)+ H2(g) △H =-41kJ·mol-1
CO2(g)+ H2(g) △H =-41kJ·mol-1
(1)向VL 恒容密闭容器中充入lmol CH3OH(g),发生反应i。图I中能正确表示CHOH(g)的平衡转化率(a)随温度(T) 变化关系的曲线为_______________(填“A”或“B”),理由为_____________。T1℃时,体系的平衡压强与起始压强之比为_________________________。

(2)起始向10L 恒容密闭容器中充入lmol CH3OH(g)和1molH2O(g),发生反应i利反应ii,体系中CO的平衡体积分数与温度(T)和压强(p)的关系如图2所示。
①随着温度升高,n(CO2)/n(CO)的值______(填“增大““减小”或“不变”),理由为____________。
②p1、p2、p3由大到小的顺序为___________________。
③测得C点时、休系中CO2的物质的量为0.2mol,则T2℃时,反应ii 的平衡常数K=________。
-
甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应如下:CO(g)+2H2(g)⇌CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
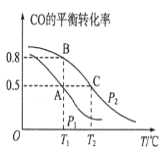
①A、B两点对应的压强大小关系是PA________PB(填“>、<、=”)。
②A、B、C三点的平衡常数KA,KB,KC的大小关系是______。
③下列叙述能说明上述反应能达到化学平衡状态的是__(填代号)。
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变 c.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,该反应的平衡常数K=___,再加入1.0molCO后重新到达平衡,则CO的转化率__(填“增大,不变或减小”)。
-
甲醇(CH3OH)是重要的化工原料,发展前景广阔。
(1)利用甲醇可制成微生物燃料电池(利用微生物将化学能直接转化成电能的装置)。某微生物燃料电池装置如下图所示:
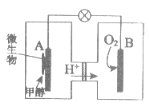
A极附近的电极反应式是_________。
(2)研究表明CO2加氢可以合成甲醇。反应如下:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①反应的化学平衡常数表达式K=_________。
②有利于提高反应中CO2的平衡转化率的措施有_________(填序号)。
a. 使用催化剂 b. 加压 c. 增大CO2和H2的初始投料比
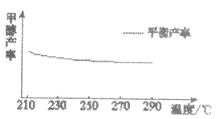
③研究温度对于甲醇产率的影响。在210℃~290℃,保持原料气中CO2和H2的投料比不变,按一定流速通过催化剂,得到甲醇的平衡产率与温度的关系如下图所示。该反应焓变 H_________0(填“>”、“=”或“<”),其依据是________。
H_________0(填“>”、“=”或“<”),其依据是________。
-
甲醇是重要的化工原料,又是可再生能源,具有开发和应用的广阔前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ⋅mol−1,2H2(g)+O2(g)═2H2O(g)△H=−484kJ⋅mol−1,工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式______________。
(2)工业上在恒容密闭容器中可采用下列反应合成甲醇CO(g)+2H2(g) CH3OH(g)ΔH
CH3OH(g)ΔH
①能判断该反应达到平衡状态的依据是_________(填母序号)。
A.2 ν逆(H 2) = ν 正(CO)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H 2的浓度都不再发生变化
E.容器内CO、H 2、CH3OH的浓度之比为1:2:1
F.CO、H2、CH3OH的速率之比为1:2:1
②CO在不同温度下的平衡转化率与压强的关系如图,该反应△H_______0(填“>”或“<”)。
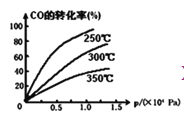
③一定温度下,将4a mol H 2和2a mol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则该反应的平衡常数为_______________。
-
甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应,CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
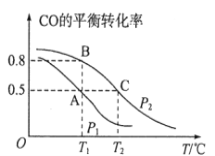
①A、B两点对应的压强大小关系是PA________PB(填“>、<、=”)。
②A、B、C三点的平衡常数KA,KB,KC的大小关系是__________________。
③下列叙述能说明上述反应能达到化学平衡状态的是__________________(填代号) 。
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,该反应的平衡常数K=__________________,再加入1.0molCO后重新到达平衡,则CO的转化率___________(填“增大,不变或减小”)。
(3)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol。此时v(正)________v(逆)(填“>、<或=”)。
-
甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
(1)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应,CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g),CO的平衡转化率与温度,压强的关系如图所示。
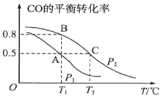
①A、B两点对应的压强大小关系是PA___PB(填“>、<、=”)。
②A、B、C三点的平衡常数KA,KB,KC的大小关系是___。
③下列叙述能说明上述反应能达到化学平衡状态的是___(填代号)。
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.CO和CH3OH的物质的量之和保持不变
(2)在P1压强、T1℃时,该反应的平衡常数K=___。
(3)T1℃、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下,CO:0.1mol、H2:0.2mol、CH3OH:0.2mol,此时v(正)___v(逆)(填“>、<或=”)。
-
甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔 前景。
前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ⋅mol−1,
2H2(g)+O2(g)═2H2O(g) △H=−484kJ⋅mol−1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:________________________________________________________________________
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g) CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
①A,B两点对应的压强大小关系是PA________PB(填“>,<,=”)
②下列叙述能说明上述反应能达到化学平衡状态的是___________(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.气体的平均相对分子质量和压强不再改变
③在P1压强、T1°C时,该反应的平衡常数K=_________(填计算结果)
④T1°C、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol, H2 :0.2mol, CH3OH:0.2mol。此时v正 ________ v逆(填> 、 < 或 =)。
-
甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔 前景。
前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ⋅mol−1,
2H2(g)+O2(g)═2H2O(g) △H=−484kJ⋅mol−1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:________________________________________________________________________
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g) CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
①A,B两点对应的压强大小关系是PA________PB(填“>,<,=”)
②下列叙述能说明上述反应能达到化学平衡状态的是___________(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.气体的平均相对分子质量和压强不再改变
③在P1压强、T1°C时,该反应的平衡常数K=_________(填计算结果)
④T1°C、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol, H2 :0.2mol, CH3OH:0.2mol。此时v正 ________ v逆(填> 、 < 或 =)。
-
甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔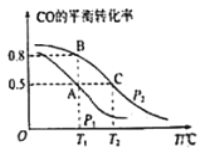 前景。
前景。
(1)已知:CH3OH(g)=HCHO(g)+H2(g) △H=+84kJ⋅mol−1,
2H2(g)+O2(g)═2H2O(g) △H=−484kJ⋅mol−1
工业上常以甲醇为原料制取甲醛,请写出CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式:________________________________________________________________________
(2)在一容积为2L的密闭容器内,充入0.2molCO与0.4molH2发生反应CO(g)+2H2(g) CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
CH3OH(g)。 CO的平衡转化率与温度,压强的关系如图所示。
①A,B两点对应的压强大小关系是PA________PB(填“>,<,=”)
②下列叙述能说明上述反应能达到化学平衡状态的是___________(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变 d.气体的平均相对分子质量和压强不再改变
③在P1压强、T1°C时,该反应的平衡常数K=_________(填计算结果)
④T1°C、1L的密闭容器内发生上述反应,测得某时刻各物质的物质的量如下:CO:0.1mol, H2 :0.2mol, CH3OH:0.2mol。此时v正 ________ v逆(填> 、 < 或 =)。
CO(g)+ 2H2(g) △H =+90kJ·mol-1
CO2(g)+ H2(g) △H =-41kJ·mol-1









 前景。
前景。 前景。
前景。 前景。
前景。