-
(16分)MnO2与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl,K2MnO4溶液经酸化后转化为MnO2和KMnO4。一种MnO2制备KMnO4的方法如下:
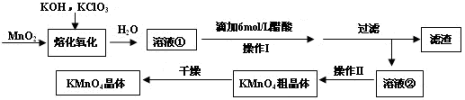
(1)写出“溶化氧化”的化学反应方程式: ;
(2)从溶液②中得到KMnO4粗晶体的方法是 ;
(3)上述流程中可以循环使用的物质是 ;
(4)理论上(若不考虑制备过程中的损失与物质循环)1mol MnO2可制的 mol KMnO4;
(5)已知293K时醋酸钾的溶解度为217g,硫酸钾的溶解度为11.1g,请解释酸化过程中采用醋酸而不采用盐酸或硫酸的原因:
①不采用盐酸的原因: ;
②不采用硫酸的原因: 。
(6)采用上述流程制备KMnO4产率并不高,为提高产率,还可以采用以下两种方法:
①在K2MnO4溶液中通入氯气,写出该反应的离子方程式 ;
②电解K2MnO4溶液,电解的总反应离子方程式为 。
-
(12分)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2 和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。请回答:
(1)软锰矿制备K2MnO4的化学方程式是
;
(2)K2MnO4制备KMnO4的离子方程式是 ;
(3)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KMnO4的理论产量;
(4)KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2,该反应的化学方程式是 ;
(5)上述制得的KMnO4产品0.165g,恰好与0.335g纯Na2C2O4反应完全,计算该KMnO4的纯度。
-
实验室可有软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4.请回答:
(1)软锰矿制备K2MnO4的化学方程式是______ 3K2MnO4+KCl+3H2O
-
实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。请回答:
(1)软锰矿制备K2MnO4的化学方程式是_______________________;
(2)K2MnO4制备KMnO4的离子方程式是_______________;
(3)若用2.5g软锰矿(含MnO2 80%)进行上述实验,KMnO4的理论产量为_______________。
(4)KMnO4能与热的经硫酸酸化的Na2C2O4溶液反应生成Mn2+和CO2,该反应的化学方程式是________________________;
(5)上述制得KMnO4产品0.165g,恰好与0.335g Na2C2O4反应完全,该KMnO4的纯度为___。
-
实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。请回答:
(1)软锰矿制备K2MnO4的化学方程式是_______________________;
(2)K2MnO4制备KMnO4的离子方程式是_______________;
(3)若用2.5g软锰矿(含MnO2 80%)进行上述实验,KMnO4的理论产量为_______________。
(4)KMnO4能与热的经硫酸酸化的Na2C2O4溶液反应生成Mn2+和CO2,该反应的化学方程式是________________________;
(5)上述制得KMnO4产品0.165g,恰好与0.335g Na2C2O4反应完全,该KMnO4的纯度为___。
-
实验室可有软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4.请回答:
(1)软锰矿制备K2MnO4的化学方程式是______ 3K2MnO4+KCl+3H2O
-
实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。
请回答:
(1)用软锰矿制备K2MnO4的化学方程式是。
(2)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为________。生成0.1mol还原产物时转移电子________ 个。KMnO4、K2MnO4和MnO2的氧化性由强到弱的顺序是________。
(3)KMnO4能与热的Na2C2O4(aq,硫酸酸化)反应生成Mn2+和CO2。若取用软锰矿制得的KMnO4产品0.165g,能与0.335g Na2C2O4恰好完全反应(假设杂质均不能参与反应),该产品中KMnO4的纯度为________。
-
(12分) 实验室可由软锰矿(主要成分为 MnO2)制备 KMnO4,方法如下:软锰矿与过量固体 KOH 和 KClO3 在高温下反应,生成锰酸钾(K2MnO4)和 KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和 KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4请回答:
(1)软锰矿制备K2MnO4的化学方程式是________。
(2)K2MnO4制备KMnO4的离子方程式是________。
(3)配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+=__CO2+__Mn2++__H2O
(4)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25.00 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1NaOH溶液至20.00 mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液至16.00 mL时反应完全,此时溶液颜色由__变为__。该溶液中还原剂的物质的量为___mol。
③原试样中H2C2O4·2H2O的质量分数为_____。
-
(12分) 实验室可由软锰矿(主要成分为 MnO2)制备 KMnO4,方法如下:软锰矿与过量固体 KOH 和 KClO3 在高温下反应,生成锰酸钾(K2MnO4)和 KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和 KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4请回答:
(1)软锰矿制备K2MnO4的化学方程式是________。
(2)K2MnO4制备KMnO4的离子方程式是________。
(3)配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+=__CO2+__Mn2++__H2O
(4)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25.00 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1NaOH溶液至20.00 mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液至16.00 mL时反应完全,此时溶液颜色由__变为__。该溶液中还原剂的物质的量为___mol。
③原试样中H2C2O4·2H2O的质量分数为_____。
-
(12分) 实验室可由软锰矿(主要成分为 MnO2)制备 KMnO4,方法如下:软锰矿与过量固体 KOH 和 KClO3 在高温下反应,生成锰酸钾(K2MnO4)和 KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和 KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4请回答:
(1)软锰矿制备K2MnO4的化学方程式是________。
(2)K2MnO4制备KMnO4的离子方程式是________。
(3)配平氧化还原反应方程式:
__ C2O42-+__MnO4-+__H+=__CO2+__Mn2++__H2O
(4)称取6.0 g含H2C2O4·2H2O、KHC2O4和K2SO4的试样,加水溶解,配成250mL溶液。量取两份此溶液各25.00 mL,分别置于两个锥形瓶中。
①第一份溶液中加入酚酞试液,滴加0.25 mol·L-1NaOH溶液至20.00 mL时,溶液由无色变为浅红色。该溶液被中和的H+的物质的量为___mol。
②第二份溶液中滴加0.10 mol·L-1的酸性高锰酸钾溶液至16.00 mL时反应完全,此时溶液颜色由__变为__。该溶液中还原剂的物质的量为___mol。
③原试样中H2C2O4·2H2O的质量分数为_____。
