-
草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4工艺流程如下:
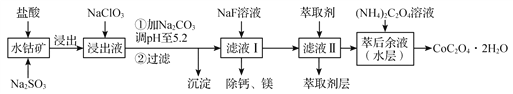
已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下Co3+的氧化能力很强。
③部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将还原_________(填离子符号)。
(2)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:___________________________________________。
(3)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)=______________________。【 已知:Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.00×10-10】
(4)已知:NH3·H2O
 +OH− Kb=1.8×10−5;
+OH− Kb=1.8×10−5;
H2C2O4 H++
H++ Ka1=5.4×10−2;
Ka1=5.4×10−2;
 H++
H++ Ka2=5.4×10−5。
Ka2=5.4×10−5。
所用(NH4)2C2O4溶液中离子浓度由大到小的顺序为______________________。
(5)从萃后余液中制取CoC2O4·2H2O,需要进行的系列操作有蒸发浓缩、__________、过滤。
-
草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4•2H2O工艺流程如下
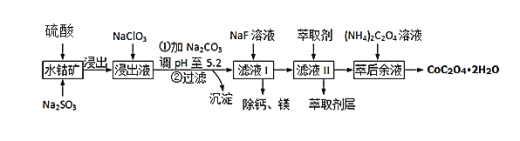
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)Co2O3中Co的化合价是________________
(2)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:________________________________________
(3)浸出液中加入NaClO3的目的是______________________________________
(4)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是____________,(填化学式)试用离子方程式和必要的文字简述其原理: _____________________________________________________________________________________
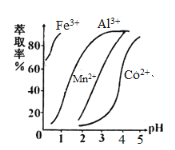
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____________________;其使用的适宜pH范围是_____.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(6)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10﹣11、Ksp(CaF2)=1.05×10﹣10,当加入过量NaF后,所得滤液 c(Mg2+)/c(Ca 2+) =_______.
(7)用m1 kg水钴矿(含Co2O3 60%)制备CoC2O4•2H2O,最终得到产品 m2 kg,产率为________________。(不要求得出计算结果,只需列出数字计算式)。
-
草酸钴可用于指示剂和催化剂的制备.用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4•2H2O工艺流程如下
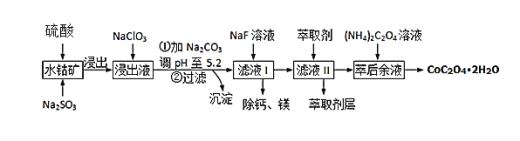
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)Co2O3中Co的化合价是________________
(2)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:________________________________________
(3)浸出液中加入NaClO3的目的是______________________________________
(4)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是____________,(填化学式)试用离子方程式和必要的文字简述其原理: _____________________________________________________________________________________
(5)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是____________________;其使用的适宜pH范围是_____.
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5

(6)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀.已知Ksp(MgF2)=7.35×10﹣11、Ksp(CaF2)=1.05×10﹣10,当加入过量NaF后,所得滤液 c(Mg2+)/c(Ca 2+) =_______.
(7)用m1 kg水钴矿(含Co2O3 60%)制备CoC2O4•2H2O,最终得到产品 m2 kg,产率为________________。(不要求得出计算结果,只需列出数字计算式)。
-
草酸钴(CoOC2O3)用途广泛,一种利用水钴矿[主要成分为Co2O3,还含少量Fe2O3、Al2O3、MgO、MnO、CaO等]制取CoC2O4·2H2O的工艺流程如下:
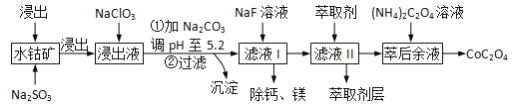
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的作用是将__________还原(填离子符号),该步反应的离子方程式为_________。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+ ,氯元素被还原为最低价。该反应的离子方程式为_______________。
(3)加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是(用离子方程式表示,写出其中一个即可)_____________。
(4)萃取剂对金属离子的萃取率与pH的关系如右图所示。使用萃取剂适宜的pH=________(填序号)左右。
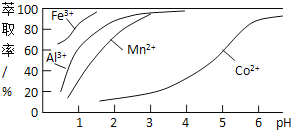
A.2.0 B.3.0 C.4.0
(5)滤液I“除钙,镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=_____。
-
二氧化锗被广泛用于制作高纯金属锗、锗的化合物、化工催化剂及医药工业, 某工厂用褐煤烟灰(主要成分为C、GeO2,还有少量Al2O3和SiO2)为原料制备GeO2,其流程如 下:
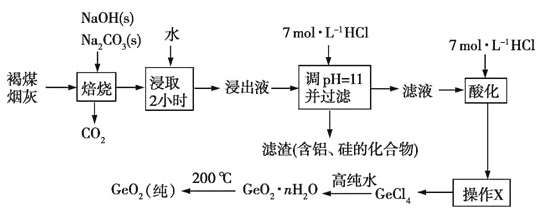
已知:GeO2不溶于水,不跟水反应,是以酸性为主的两性氧化物,可溶于浓盐酸生成四氯化锗,也可溶于强碱溶液,生成锗酸盐。操作X为蒸馏
(1)褐煤灰中加入NaOH和Na2CO3固体进行焙烧时,要加入过量的粉碎的NaOH和Na2CO3固体,其原因是_________________。写出GeO2与NaOH反应的化学方程式:__________。
(2)为提高含锗化合物的浸出率,除采用水浸取焙烧物2小时外,还可采取的措施有_____________。(写出两条即可)
(3)浸出液中滴加7mol/L盐酸,调节溶液的pH约为11,目的是__________。
(4)滴加7mol/L盐酸使滤液“酸化”,若滤液“酸化”时酸度不够,溶液会出现明显的浑浊,该沉淀物是________________,(写化学式)
(5)GeCl4的沸点是83.1℃,其电子式为______________。
(6)单质锗可用作电子工业的半导体材料。由纯净的GeO2和H2在加热的条件下可制得单质锗.该反应的化学方程式为_________________。
-
二氧化锗被广泛用于制作高纯金属锗、锗化合物、化工催化剂及医药工业,某工厂用褐煤烟灰(主要成分C、GeO2,还有少量Al2O3和SiO2)为原料制备GeO2,其流程如下:
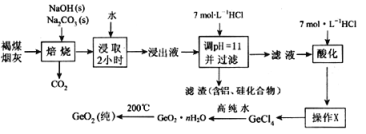
已知:GeO2难溶于水,不跟水反应,是以酸性为主的两性氧化物,溶于强碱溶液生成锗酸盐,与浓盐酸生成GeCl4(GeCl4的沸点是83.1℃)
(1)用水浸取焙烧物2小时的目的是____________________,操作“X”的名称为________,该操作除了冷凝管、铁架台、牛角管、锥形瓶、石棉网、酒精灯外还缺少的玻璃仪器是________
(2)写出焙烧时二氧化锗与氢氧化钠发生反应的化学方程式________________________________
(3)“酸化”至溶液中盐酸浓度为5.3 mol/L时有利于生成GeCl4,写出该反应的化学方程式:____若滤液“酸化”时酸度不够,溶液会出现明显的浑浊,原因是____________
(4)GeO2产品中通常混有少量SiO2。取样品w g,测得其中氧原子的物质的量为n mol,则该样品中GeO2的物质的量为____________mol(用含w、n的代数式表示)
-
钴的化合物用途广泛。一种利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等)制取CoCl2·6H2O粗品的工艺流程如下:
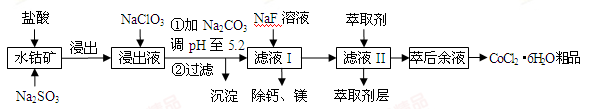
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式完全沉淀时的pH如下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
③CoCl2·6H2O熔点为86℃,加热至110℃~120℃时,失去结晶水生成无水氯化钴。
请回答下列问题:
(1)写出“浸出”时Co2O3发生反应的离子方程式:_____________________________。
(2)加入NaClO3的作用是_______。
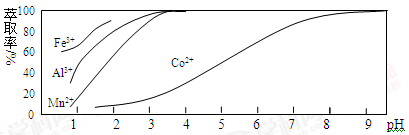
(3)萃取剂对金属离子的萃取率与pH的关系如下图所示。向“滤液II”中加入萃取剂的主要目的是_______,使用萃取剂时最适宜的pH是_____(填字母序号)。
A. 2.0~2.5 B. 3.0~3.5 C.5.0~5.5 D.9.5~9.8
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知某温度下,Ksp(MgF2)=7.35×10-11,Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=________。
(5)制得的CoCl2·6H2O粗品经进一步提纯得到CoCl2·6H2O晶体,在烘干晶体时需采用减压烘干,其原因是________。
(6) 某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe-=== LixC6。在电池充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式
__________________________________。
-
(共7分)KMnO4是一种用途广泛的氧化剂,可由软锰矿(主要成分为MnO2)通过下列方法制备:①软锰矿与过量KOH、KClO3固体熔融生成K2MnO4;②溶解、过滤后将滤液酸化,使K2MnO4完全转化为MnO2和KMnO4;③滤去MnO2,将滤液浓缩、结晶得到深紫色的KMnO4产品。
(1)溶液酸化时,K2MnO4转变为MnO2和KMnO4的离子方程式是
;
(2)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定。
①配制250 mL0.1 mol/L标准Na2S2O3溶液,需准确称取Na2S2O3固体的质量为 g;
②取上述制得的KMnO4产品0.6000g,酸化后用0.1mol/L标准Na2S2O3溶液进行滴定,滴定至终点消耗Na2S2O3溶液20.00 ml。计算该KMnO4产品的纯度(请给出计算过程)。
 (有关离子方程式为:MnO4-+S2O32-+H+ SO42-+Mn2++H2O 未配平)
(有关离子方程式为:MnO4-+S2O32-+H+ SO42-+Mn2++H2O 未配平)
-
利用水钴矿[主要成分为Co2O3和Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
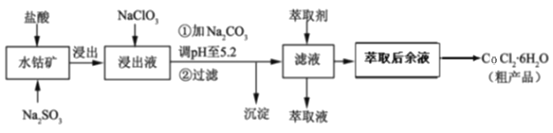
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)提高水钴矿浸出速率的措施有_______________________________________(填写两点),浸出过程中Co2O3发生反应的离子方程式为________________________。
(2)NaClO3的作用是_________________________________。
(3)加Na2CO3调pH至5.2所得沉淀为_________________。
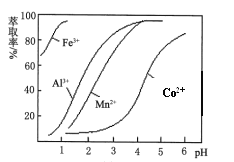
(4)萃取剂对金属离子的萃取率与pH的关系如图。萃取剂的作用是___________________________________________;其使用的适宜pH范围是______________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5
(5)由萃取后余液获得粗产品的操作步骤为_____________。
-
利用水钴矿[主要成分为Co2O3和Co(OH)3,还有少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如图所示:
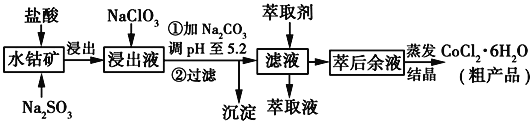 已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式__________________________。
(2)NaClO3的作用是___________________________________。
(3)加Na2CO3调pH至5.2所得沉淀为____________________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。萃取剂的作用是_____;其使用的适宜pH范围是_____(填字母)。
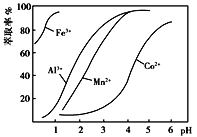
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5

+OH− Kb=1.8×10−5;
H++
Ka1=5.4×10−2;
H++
Ka2=5.4×10−5。












 已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等: