-
目前,人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,能使有毒气体转化为无毒气体:4CO(g)+2N02(g) C02(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是_____填字母);
C02(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是_____填字母);
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C. 2v逆(NO2)=v正(N2)
D.容器内混合气体密度保持不变
(2)用活性炭还原法也可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g)△H。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g)△H。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
| 时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
| 浓度/mol·L-1 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析Tl℃时,该反应在0~20 min的平均反应速率v(C02)=___;计算该反应的平衡常数K=____。(保留两位有效数字)
②根据上表数据判断,由30 min到40 min时改变的条件可能是(任写一种)_____。
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g)△H=+116.5kJ/mol
③H2O(l)=H2O(g)△H=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式____。
(4)科学家利用原电池原理,在酸性溶液中将N02转化为HN03,则该转化的负极电极方程式为____。
-
目前,人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体:4CO(g)+2NO2(g) 4CO2(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是________(填序号);
4CO2(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是________(填序号);
A.容器内混合气体颜色不再变化 B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2) D.容器内混合气体密度保持不变
(2)用活性炭还原法也可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
| 时间/min 浓度/( mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0~20 min的平均反应速率v(CO2)=________;计算该反应的平衡常数K=______。
②根据上表数据判断,由30 min到40 min时改变的条件可能是(任写一种)__________________。
③30 min后升高温度至T2℃,达到新平衡时,容器中NO、N2、CO2的浓度之比为5∶3∶3,此时NO的转化率_______(填“升高”或“降低”),ΔH_____0(填“>”或“<”)。
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH=-l59.5 kJ· mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH= +116.5 kJ· mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ· mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式_____________________。
(4)科学家利用原电池原理,在酸性介质中将NO2转化为HNO3,则该转化的负极反应式为:_________________________________。
-
目前人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体。
4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 (填代号)。

(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s) + 2NO(g) N2(g) + CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g) + CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
| 时间/min
浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(CO2)= ;计算该反应的平衡常数K= 。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是 (填字母代号)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”),ΔH 0(填“>”或“<”).
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH= -l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH= +116.5kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式 。
(4)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液。
电池反应为:4NH3+3O2=2N2+6H2O;
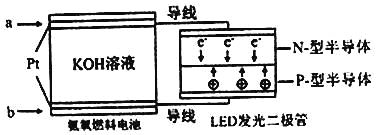
请写出通入a气体一极的电极反应式为 ;每消耗3.4g NH3转移电子的物质的量为 。
-
目前人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体。
4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 (填代号)。
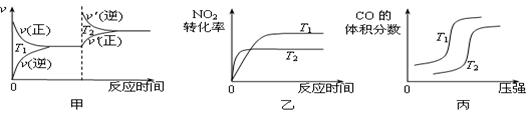
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s) + 2NO(g)  N2(g) + CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g) + CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
| 时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(CO2)= ;计算该反应的平衡常数K= 。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是 (填字母代号)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”),ΔH 0(填“>”或“<”).
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH= -l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH= +116.5kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式 。
(4)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液。
电池反应为:4NH3+3O2=2N2+6H2O;

请写出通入a气体一极的电极反应式为 ;每消耗3.4g NH3转移电子的物质的量为 。
-
目前人们对环境保护、新能源开发很重视。
(1)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体。
4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 (填代号)。
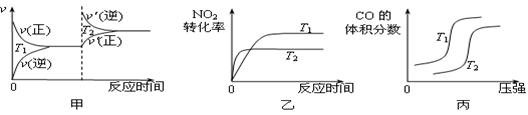
(2)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s) + 2NO(g)  N2(g) + CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g) + CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
| 时间/min 浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0-20min的平均反应速率v(CO2)= ;计算该反应的平衡常数K= 。
②30min后,只改变某一条件,根据上表的数据判断改变的条件可能是 (填字母代号)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的体积 D.加入合适的催化剂
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率 (填“升高”或“降低”),ΔH 0(填“>”或“<”).
(3)以CO2与NH3为原料可合成化肥尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) ΔH= -l59.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ΔH= +116.5kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0kJ/mol
写出CO2与NH3合成尿素和液态水的热化学反应方程式 。
(4)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液。
电池反应为:4NH3+3O2=2N2+6H2O;
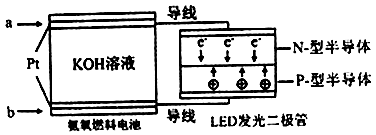
请写出通入a气体一极的电极反应式为 ;每消耗3.4g NH3转移电子的物质的量为 。
-
汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。
(1)汽车尾气中CO、NO2气体在一定条件下可以发生反应:
4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1
①恒温恒容条件下,不能说明该反应已达到平衡状态的是________(填序号);
A.容器内混合气体颜色不再变化 B.容器内的压强保持不变
C.2v逆(NO2)=v正(N2) D.容器内混合气体密度保持不变
②能使该反应的反应速率增大,且平衡向逆反应方向移动的是________(填序号);
A.及时分离出CO2 B.适当升高温度
C.减小容器体积使体系压强增大 D.选择高效催化剂
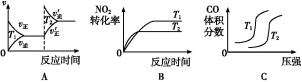
③对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是________(填序号);
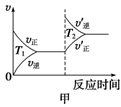
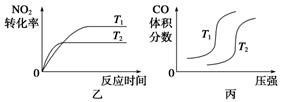
(2)汽车尾气中CO与H2O(g)在一定条件下可以发生反应:CO(g)+H2O(g) CO2(g)+H2(g) ΔH<0;820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照右表进行投料,达到平衡状态时K=1.0。
CO2(g)+H2(g) ΔH<0;820 ℃时在甲、乙、丙三个恒容密闭容器中,起始时按照右表进行投料,达到平衡状态时K=1.0。
| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
①该反应的平衡常数表达式为___________;平衡时,甲容器中CO的转化率=________;
②平衡时,比较下列容器中CO的转化率:乙 ________ 甲(填“>”、“=”或“<”,下同);丙 ________ 甲。
-
汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。汽车尾气中CO、NO2气体在一定条件下可以发生反应:4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
(1)恒温恒容条件下,不能说明该反应已达到平衡状态的是 (填字母,下同)。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.2v(NO2)逆=v(N2)正
D.容器内混合气体密度保持不变
(2)能使该反应的反应速率增大,且平衡向逆反应方向移动的是 。
A.及时分离出CO2
B.适当升高温度
C.减小容器体积使体系压强增大
D.选择高效催化剂
(3)对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 。
-
(10分)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体。
(1)汽油在不同空/燃比(空气与燃油气的体积比)时尾气的主要成分不同,空/燃比较小时的有毒气体主要是▲ (填化学式)。
(2)人们把拆开1 mol化学键所吸收的能量看成该化学键的键能。
已知:N2、O2分子中化学键的键能分别是946 kJ·mol-1、497 kJ·mol-1。
查阅资料获知如下反应的热化学方程式:
N2(g)+O2(g)=2NO(g) ΔH=+180 kJ·mol-1
N2(g)+2O2(g)=2NO2(g) ΔH=+68 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH=-221 kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
① 一定条件下,N2与O2反应生成NO能够自发进行,其原因是▲ ;NO分子中化学键的键能为▲ kJ·mol—1。
② CO与NO2反应的热化学方程式为4CO(g)+2NO2(g)=4CO2(g)+N2(g)
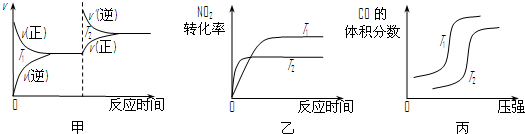
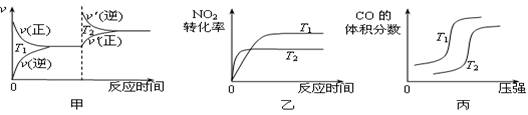 ΔH=▲ 。对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是▲ (填代号)。
ΔH=▲ 。对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是▲ (填代号)。
-
汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化成无毒气体.
(1)汽油在不同 比(空气与燃油气的体积比)时尾气的主要成分不同,
比(空气与燃油气的体积比)时尾气的主要成分不同, 比较小时的有毒气体主要是______(填化学式).
比较小时的有毒气体主要是______(填化学式).
(2)人们把拆开1mol化学键所吸收的能量看成该化学键的键能.
已知:N2、O2分子中化学键的键能分别是946kJ•mol-1、497kJ•mol-1.
查阅资料获知如下反应的热化学方程式:
N2(g)+O2(g)=2NO(g)△H=+180kJ•mol-1
N2(g)+2O2(g)=2NO2(g)△H=+68kJ•mol-1
2C(s)+O2(g)=2CO(g)△H=-221kJ•mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ•mol-1
①一定条件下,N2与O2反应生成NO或NO2均能够自发进行,其原因是______;NO分子中化学键的键能为______kJ•mol-1.
②CO与NO2反应的热化学方程式为4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=______.对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是______(填代号).
(3)目前科学家设想将排放到空气中CO2转化为有机物来有效实现碳循环,如:
A.6CO2+6H2O  C6H12O6+6O2 B.CO2+3H2
C6H12O6+6O2 B.CO2+3H2 CH3OH+H2O
CH3OH+H2O
C.CO2+CH4 CH3COOH D.2CO2+6H2
CH3COOH D.2CO2+6H2 CH3OCH3+3H2O
CH3OCH3+3H2O
以上反应中原子利用率最高的是______,最节能的是______.某物质X的核磁共振氢谱只有一个峰,可与CO2发生加聚反应生成可降解塑料,反应如下: ,则X的结构简式为______.
,则X的结构简式为______.
-
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NO2等有毒气体,其污染问题也成为当今社会急需解决的问题。
I.对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体。2xCO+2NOx ==2xCO2+N2,当转移电子物质的量为0.8x mol时,该反应生成 LN2(标准状况下)。
II.一氧化碳是一种用途相当广泛的化工基础原料。可以还原金属氧化物,可以用来合成很多有机物如甲醇(CH3OH)、二甲醚(CH3OCH3)等,还可以作燃料。
(1)在压强为0.1 MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇: CO(g)+2H2(g) CH3OH(g) △H<0
CH3OH(g) △H<0
①该反应的平衡常数表达式为 。
②若容器容积不变,下列措施可增加甲醇产率的是 。
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1 mol CO和3 mol H2
(2)已知:①CO(g)+2H2(g)CH3OH(g) △H=-90.7 kJ·mol-1
②2CH3OH(g)CH3OCH3(g)+H2O(g) △H=-23.5 kJ·mol-1
③CO(g)+H2O(g)CO2(g)+H2(g) △H=-41.2 kJ·mol-1
则3CO(g)+3H2(g)CH3OCH3(g)+CO2(g)的△H=
(3)CO—空气燃料电池中使用的电解质是掺杂Y2O3的ZrO2晶体,它在高温下能传导O2—,该电池负极的电极反应式为 。
(4)甲醇也是新能源电池的燃料,但它对水质会造成一定的污染。有一种电化学法可消除这种污染。其原理是: 2滴甲醇,1mL 1.0mol·L—1硫酸,4mL 0.1mol·L—1硫酸钴
(CoSO4)混合溶液,插上两根惰性电极,通电后,将Co2+氧化成Co3+,
然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用图装置模拟上述过程:
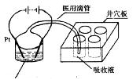
①检验电解时产生的CO2气体,井穴板穴孔内应盛放 溶液。
②写出净化甲醇的离子方程式 。
4CO2(g)+N2(g),恒温恒容条件下,能够说明该反应已达到平衡状态的是________(填序号);
N2(g)+CO2(g) ΔH。在T1℃时,反应进行到不同时间测得各物质的量浓度如下:









 ΔH=
ΔH=
