-
[化学—选修物质结构和性质](15分)
下表为部分短周期元素的性质或原子结构,已知A—D的原子序数依次增大。
| 元素编号 | 元素性质或原子结构 |
| A | A原子所处的周期数、族序数、原子序数均相等 |
| B | 核外电子有6种不同运动状态 |
| C | 最简单氢化物的水溶液呈碱性 |
| D | 基态原子的S轨道电子数等于P轨道电子数 |
请结合表中信息完成下列各小题(答题时用所对应的元素符号)
A:(1)写出C原子的电子排布图____________
(2)A、B、C、D的第一电离能由大到小的顺序为______________
(3)用电离方程式表示C的最简单氢化物的水溶液呈碱性的原因 _______________
B:按照共价键理论,分子中每个原子的最外电子层电子数均已饱和。已知ABCD分子可能有三种不同结构,它们的结构可以从其他物质的结构中获得启发。
(4)ABC的结构式是___________。向其中插入一个D原子,若形成配位键(用→表示)则ABCD的结构式为______________分子中C的原子的杂化类型是______________;若无配位键则ABCD的结构式为___________分子中D原子的杂化类型为______________。
(5)BD2的电子式是____________将D原子换成等电子的 所得ABCD的结构式为________,分子中C原子的杂化类型是______________。
所得ABCD的结构式为________,分子中C原子的杂化类型是______________。
(6)在ABCD的三种可能结构中B原子的杂化类型__________(填“相同”或“不相同”)
-
【化学——选修3:物质结构与性质】(15分)
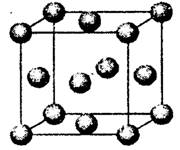
已知A、B、C、D、E是元素周期表中1~36号元素,其原子序数依次增大,且A、B、C、D为主族元素。A与另外四种元素既不在同一周期,也不在同一主族。B和C同主族,D和E同周期;元素E是周期表中的第7列元素,D的最外层电子数与最内层电子数相同,D跟B可形成离子化合物,其晶胞结构(其中B原子在晶胞内部)如图。
请回答下列问题:
(1)C-的电子排布式为______________;E元素原子的价电子排布式为________。
(2)元素B与氮元素可以形成化合物NB3,其中N—B键的化学键类型为________,根据价层电子对互斥理论可以判断NB3的空间构型为________,NB3分子中N原子的杂化方式为________杂化。
(3)A、B形成的化合物AB的相对分子质量比A、C形成的化合物AC的相对分子质量小,但AB的沸点比AC高,其原因是 。
(4)从晶胞图可以得出:D与B形成的离子化合物的化学式为 。
(5)含有D元素的化合物焰色反应为______色,焰色反应的原理是 。
-
选做[化学——选修3:物质结构与性质](15分)已知A、B、C、D、E、F都是元素周期表中前36号的元素,它们的原子序数依次增大。A的一种单质是自然界硬度最大的物质,B是地壳中含量最多的元素,C的单质能从B的一种氢化物中置换出B的一种单质,D是人体骨骼中的常见元素,D的氢氧化物常用来检验A和B形成的一种化合物,F的原子序数比E大1,F是Ⅷ族元素中原子序数最小的一种元素。
(1)E的基态原子电子排布式为 ,比较F和 E的各级电离能后发现,气态E2+再失去一个电子比气态F2+再失去一个电子难,其原因是 。
(2)写出 DA2的电子式 。
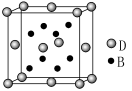
(3)DC2的一个晶胞如图所示,则图中实心球表示D还是C?
答: (填元素名称)。该晶体的密度为a g/cm3,则晶胞的体积是 (只要求列出算式)。
(4)AB32- 离子的空间立体构型为 ,AB气体在配合物中常作为配体,如近年来开始使用的一种新型汽油防震剂F(AB)5,该化合物中F元素的化合价为 。
-
【化学—选修3:物质结构与性质】(15分)已知位于元素周期表前四周期的六种元素A、B、C、D、E、F的原子序数之和为107,且它们的核电荷数依次增大。B原子的p轨道半充满,其氢化物沸点是同族元素中最低的,D原子得到一个电子后3p轨道全充满,A与C能形成A2C型离子化和物,其中的阴、阳离子相差一个电子层,E4+离子和氩原子的核外电子排布相同。请回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序是____________(填元素符号)
(2)化合物BD3的分子空间构型可描述为_________,B的原子轨道杂化类型为_______。
(3)已知F元素在人体内含量偏低时,会影响O2在体内的正常运输。已知F2+与KCN溶液反应得F(CN)2沉淀,当加入过量KCN溶液时沉淀溶解,生成配合物。则F的基态原子价电子排布式为________________。CN-与___________(一种分子)互为等电子体,则1个CN-中π键数目为___________。
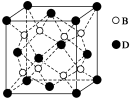
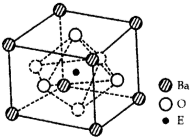
(4)EO2与碳酸钡在熔融状态下反应,所得晶体的晶胞结构如图所示,则该反应的化学方程式为__________
在该晶体中,E4+的氧配为数为___________。若该晶胞边长为a nm可计算该晶体的密度为__________g/cm3(阿伏加德罗常数为NA)
-
[化学—选修3:物质结构与性质](15分)
在周期表中1~36号之间的A、B、C、D、E、F六种元素,它们的原子序数依次增大,已知A与其余五种元素既不同周期也不同主族,B的一种核素在考古时常用来鉴定一些文物的年代,C元素原子的最外层有3个自旋方向相同的未成对电子,D原子核外电子有8种不同的运动状态,E元素在第四周期,E的基态原子中未成对电子数是核外电子总数的1/4,F元素位于周期表的ds区,其基态原子最外能层只有一个电子。
(1)写出基态E原子的价电子排布式 。
(2)B、C、D三种元素第一电离能由小到大的顺序为 (用元素符号表示)。
(3)A与C形成CA3型分子,分子中C原子的杂化类型为 ,分子的立体结构为 ;C的单质与化合物BD是等电子体,根据等电子体原理,写出化合物BD的电子式 。
(4)A2D的沸点在同族元素中最高,其原因是 。A2D由液态形成晶体时密度 (填“增大”、“不变”或“减小”),其主要原因 (用文字叙述)。
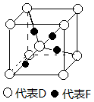
(5)已知D、F能形成一种化合物,其晶胞的结构如图所示,则该化合物的化学式为 (用元素符号表示);若相邻D原子和F原子间的距离为a cm,阿伏伽德罗常数为NA,则该晶体的密度为 g·cm-3(用含a、NA的符号表示)。
-
【化学-选修3:物质结构与性质】
已知A、B、C、D、E、F是周期表前四周期的元素,原子序数依次增大。A的基态原子2p能级有2个单电子;C占整个地壳质量的48.6%,是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子, 是热和电最佳导体之一,是唯一的能大量天然产出的金属;D与F不同周期,但最外能层电子数相等。
(1)写出基态D原子的价电子排布式 。
(2)A、B、C三种元素第一电离能最大的是 (用元素符号表示)
其原因是 。
(3)A、C两元素形成的化合物AC2的分子空间构型 _ _。 与 AC2互为等电子体的粒子的化学式_ , __ _(分子和离子各写一种)。
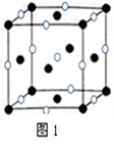
(4)D、E形成的一种离子化合物,在图1晶胞结构图中黑球表示E的位置,白球表示D的位置,已知该晶胞的边长为n cm,阿伏加德罗常数为NA,求:
晶胞的密度ρ= g/cm3(用含a、NA的计算式表示)。
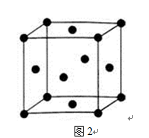
(5)由F原子形成的晶胞结构如图2,F原子的半径为r,列式表示E原子在晶胞中的空间利用率 (不要求计算结果)。
-
【化学——选修3:物质结构与性质】已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素。相关信息如下:
| X元素是宇宙中最丰富的元素 |
| Y元素基态原子的核外p电子数比s电子数少1 |
| Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
| R元素在元素周期表的第十一列 |
| Q元素在周期表里与R元素在同一个分区 |
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是 ,离子化合物YX5的电子式是 。
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是 个。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做一种含氧酸盐)。A晶体的晶胞为正方体(如右图)。
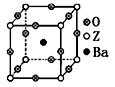
①制备A的化学反应方程式是 ;
②在A晶体中,Z的配位数为 ;
③在A晶体中,若将Z元素置于立方体的体心,Ba元素置于立方体的顶点,则O元素处于立方体的 。
(4)R2+离子的外围电子层电子排布式为 。R2O的熔点比R2S的 (填“高”或“低”)。
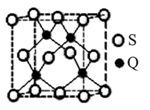
(5)Q元素和硫(S)元素能够形成化合物B。B晶体的晶体为正方体(如右图),若晶胞棱长为540.0 pm,则晶胞密度为 g·cm—3(列式并计算)。
-
【化学——选修3:物质结构与性质】
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素。相关信息如下:
| X元素是宇宙中最丰富的元素 |
| Y元素基态原子的核外p电子数比s电子数少1 |
| Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
| R元素在元素周期表的第十一列 |
| Q元素在周期表里与R元素在同一个分区 |
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是 ,离子化合物YX5的电子式是 。
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是 个。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做
一种含氧酸盐)。A晶体的晶胞为正方体(如右图)。
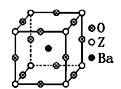
①制备A的化学反应方程式是 ;
②在A晶体中,Z的配位数为 ;
③在A晶体中,若将Z元素置于立方体的体心,Ba元素置于立方体的顶点,则O元素处于立方体的 。
(4)R2+离子的外围电子层电子排布式为 。R2O的熔点比R2S的 (填“高”或“低”)。
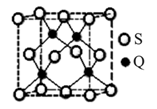
(5)Q元素和硫(S)元素能够形成化合物B。B晶体的晶胞为正方体(如右图),若晶胞棱长为540.0 pm,则晶胞密度为 g·cm—3(列式并计算)。
-
【化学——选修3:物质结构与性质】(15分)
A、B、C、D、E是元素周期表中五种短周期元素,原子序数依次增大。A、B、C、D位于同一周期。已知A原子核外有3个能级,且每个能级上的容纳的电子数目相同。C与E同主族,且C的单质为空气中的主要成份。X元素的原子核外有26个运动状态完全不相同的电子。回答下列问题:
(1)C、D、E中第一电离能最大的是 (填元素符号),X的价电子排布式为 。
(2)B的气态氢化物分子呈 形。该分子的中心原子的杂化方式为 。
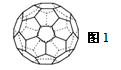
(3)A的一种单质相对分子质量为720,分子构型为一个32面体,其中有12个五元环,20个六元环(如图1)。则1molA的这种单质中π键的数目为 。
(4)X元素对应的单质在形成晶体时,采用如图2所示的堆积方式。
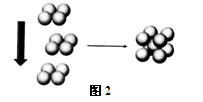
则这种堆积模型的配位数为 ,如果X的原子半径为a cm,阿伏加德常数的值为NA,则计算此单质的密度表达式为 g/cm3(不必化简)。
-
【化学一一选修物质结构与性质】 (15分)
已知A、B、C、D都是元素周期表中前36号的元素,它们的原子序数依次增大。A原子核外部分电子排布式为:NsnNpn;B原子核外2P轨道有3个未成对电子:C原子核外S能级电子总数和P能级电子总数相同,且P能级成对电子数等于未成对电子数:D原子核外M层全充满,N层只有1个电子。
请回答:
(1)B元素外围电子排布图为:________。
(2)A、B、C的第一电离能由大到小顺序为________,电负性由大到小顺序为 ________(用元素符号回答)。
(3)B和C两元素形成的阴离子BC-3中B的杂化类型为________,空间构型为________。
(4)与BC-3互为等电子体且含有A、C两元素的微粒是________。(写化学式)
(5)比较A、B的氢化物在水中溶解度大小并说明原因________。
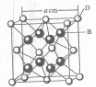
(6)D元素基态原子电子排布________,该元素单质形成的晶体晶胞如图所示,则D元素单质的堆积方式为________,已知D原子半径为r,相对原子质量为Mr,则D元素单质的密度可表示为________。(用NA表示阿伏加德罗常数)