-
(11分 )A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;
D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
请回答下列问题:
(1) X的化学式为______,D的原子结构示意图为______。
(2) 元素的非金属性C______E(填“>”、“<”或“=”),下列各项中,能说明这一结论的事实有______(填序号)。
① 氢化物H2E的酸性比H2C强
② 氢化物H2C的热稳定性比H2E强
③ 氢化物H2E的水溶液放置在空气中会变浑浊
(3) 将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。
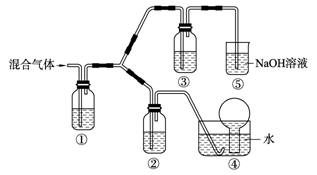
已知(ⅰ) 浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ⅱ) NaOH溶液与BC2反应的化学方程式为:
2NaOH+2BC2==NaBC2+NaBC+H2O
NaOH溶液与BC气体不反应
a. 装置①、②、③中盛放的药品依次是______、______、______。
b. 通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是______(填一种气体的化学式)。
c. 能够说明实验已成功的现象是___________________________。
高三化学填空题中等难度题查看答案及解析
-
(16分)A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
请回答下列问题:
(1)X的化学式为_____________,D的原子结构示意图为_____________。
(2)元素的非金属性C______ E(填“>”、“<”或“=”)。
下列各项中,能说明这一结论的事实有______________(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
(3)BC和BC2气体可用纯碱溶液吸收,有关化学方程式为:
2 BC2+Na2CO3=NaBC2+NaBC3+CO2↑
BC+BC2+Na2CO3=2NaBC2+CO2↑
① 配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O多少克?
② 现有1000g质量分数为21.2%的纯碱吸收液,吸收BC和BC2混合气体,每产生22.4L(标准状况)CO2时,吸收液质量增加44g。
(a)计算吸收液中NaBC2和NaBC3物质的量之比。
(b)1000g质量分数为21.2%的纯碱吸收液在20℃经充分吸收BC和BC2混合气体后,蒸发掉688g水,冷却到0℃,最多可析出NaBC2多少克?(0℃时,NaBC2的溶解度为71.2g /100g水)
高三化学填空题中等难度题查看答案及解析
-
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的周期序数与族序数相同且A元素原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐M;D与A同主族,且与E同周期;E元素原子的最外层电子数比次外层电子数少2;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。
请回答下列问题:
(1) C和E两种元素相比较,非金属性强的元素在周期表中的位置为________,以下三
种说法中,可以验证C和E非金属性强弱的是(填写编号)________;
a.比较这两种元素的常见单质的沸点
b.二者形成的化合物中,C元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(2) B、D元素所形成化合物的电子式为____________________,B、C、D 元素原子所对应离子半径由大到小的顺序为________________________________;
(3)盐M中含有的化学键类型有________、________;
(4)写出由A、C、D、E四种元素共同形成的两种化合物在水溶液中相互反应的离子方程式为________。
(5)B2A4是一种可燃性液体,B2A4—空气燃料电池是一种碱性燃料电池,B2A4的氧化产物为B2。则负极上的电极反应式为________。
(6)已知1mol D与水反应放出283.5kJ的热量,试写出D与水反应的热化学反应方程式________。
高三化学填空题中等难度题查看答案及解析
-
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X; D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。请回答下列问题:
(1)X的名称为_________,A、C、D构成的化合物中含有的化学键有 。
(2)下列各项中,能说明元素C比E非金属性强的事实有____________(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
④C与E组成化合物,C显负价
(3)将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。
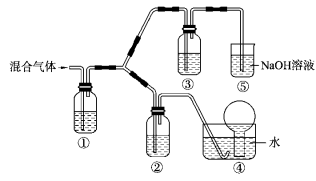
已知(ⅰ)浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ⅱ)NaOH溶液与BC2反应的化学方程式为:
2NaOH+2BC2 NaBC2+NaBC3 + H2O, NaOH溶液与BC气体不反应。
装置①、②、③中盛放的药品依次是______、______、 ______。
(4)通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是______(填一种气体的化学式)。
高三化学推断题困难题查看答案及解析
-
有原子序数依次增大的A、B、C、D、E、F六种短周期元素;A元素的原子半径是所有元素中原子最小的;C元素的最高价氧化物对应水化物与其氢化物能生成盐M;E与A同主族,且与E同周期;F元素原子的最外层电子数比次外层电子数少2;A、B、C、E、F这五种元素,每—种与D元素都能形成原子个数比不相同的若干种化合物。请回答:
(1)D元素在周期表中的位置为______________。
(2)可以比较D和F得电子能力强弱的是___________________(填写编号)。
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有______________________;并写出其中阳离子的电子式_________________。
(4)已知1molE与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式
________________________________________________________________。
(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如下图所示。
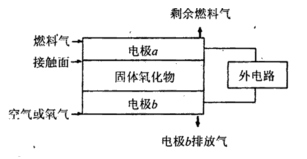
①固体氧化物中的O2-向_________(填“正”或“负”)极移动。
②电极b为电池_________极,其电极反应式为______________________________。
③若
作为燃料气,则接触面上发生的反应为______________________________。
④若
作为燃料气,则接触面上发生的反应为________________________________。
高三化学填空题困难题查看答案及解析
-
有原子序数依次增大的A、B、C、D、E、F六种短周期元素;A元素的原子半径是所有元素中原子最小的;C元素的最高价氧化物对应水化物与其氢化物能生成盐M;E与A同主族,且与E同周期;F元素原子的最外层电子数比次外层电子数少2;A、B、C、E、F这五种元素,每-种与D元素都能形成原子个数比不相同的若干种化合物.请回答:
(1)D元素在周期表中的位置为______.
(2)可以比较D和F得电子能力强弱的是______(填写编号).
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐M中含有的化学键类型有______;并写出其中阳离子的电子式______.
(4)已知1mol E与水反应放出283.5kJ的热量,试写出E与水反应的热化学反应方程式______.
(5)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质.其工作原理如图所示.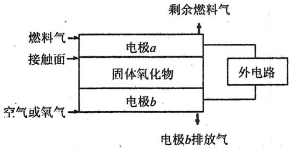
①固体氧化物中的O2-向______(填“正”或“负”)极移动.
②电极b为电池______极,其电极反应式为______.
③若A2作为燃料气,则接触面上发生的反应为______.
④若B2A4作为燃料气,则接触面上发生的反应为______.高三化学解答题中等难度题查看答案及解析
-
A、B、C、D、E、F、G、H是元素周期表中八种原子序数依次增大的短周期元素。
①A元素的原子半径在周期表中最小
②B元素的原子最外层电子数是次外层电子数的两倍
③C元素的最高价氧化物的水化物和氢化物反应生成盐
④D元素和E元素可以形成E2D、E2D2两种离子化合物
⑤G与D两种元素同主族,F、G、H三种元素同周期
⑥F元素是同周元素中离子半径最小的元素,H元素是同周期元素中原子半径最小的元素
(1)写出A、D、E三种元素形成的化合物的电子式________;
(2)用惰性电极电解由E与H两元素形成的化合物的水溶液,其化学方程式为________;
(3)八种元素中任意三种组成的易溶于水的酸性物质,能促进水电离的是________,能抑制水电离的是________(各写一种化学式);
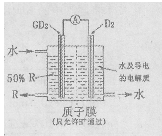
(4)某科研单位依据电化学原理用GD2来制备一种强酸R,装置如右图,电极为含有某种催化剂的多孔材料,能吸附气体,同时也能使气体与电解质溶液充分接触。通入GD2的电极为________极,其电极反应式为________;
(5)甲、乙、丙分别是B、F、G三种元素最高价含氧酸的钠盐,甲、乙都能与丙发生反应,且丙用量不同,反应产物不同。回答问题:
①向甲溶液中缓慢滴加过量的丙溶液,可观察到的实验现象是________;
②向乙溶液中缓慢滴加过量的丙溶液发生反应的离子方程式为、________。
高三化学填空题中等难度题查看答案及解析
-
A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。请回答下列问题:
(1)X的化学式为______
(2)元素的非金属性C______E(填“>”、“<”或“=”),下列各项中,能说明这一结论的事实有______(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
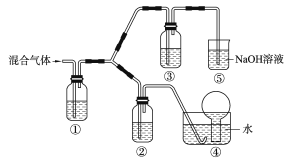
(3)将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。
已知(ⅰ)浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ⅱ)NaOH溶液与BC2反应的化学方程式为:
2NaOH+2BC2
NaBC2+NaBC + H2O
NaOH溶液与BC气体不反应
a.装置①、②、③中盛放的药品依次是______、______、______。
b.通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是______(填一种气体的化学式)。
c.能够说明实验已成功的现象是___________________________。
高三化学填空题中等难度题查看答案及解析
-
A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;
D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4倍;C与E同主族.
请回答下列问题:
(1)X的化学式为______,D的原子结构示意图为______.
(2)元素的非金属性C______E(填“>”、“<”或“=”),下列各项中,能说明这一结论的事实有______(填序号).
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
(3)将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强.
已知(ⅰ) 浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC.
(ⅱ) NaOH溶液与BC2反应的化学方程式为:2NaOH+2BC2═NaBC2+NaBC+H2O NaOH溶液与B、C气体不反应
a.装置①、②、③中盛放的药品依次是______、______、______.
b.通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是______(填一种气体的化学式).
c.能够说明实验已成功的现象是______.高三化学解答题中等难度题查看答案及解析
-
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A是周期表中原子半径最小的元素;B元素的最高价氧化物的水化物与其氢化物能相互反应生成盐;A元素与C元素可形成两种液态化合物,其原子个数比分别为1:1和2:1,旦分子中电子总数分别为18和10;D元素的主族序数等于其周期数;E元素原子的最外层电子数是其电子层数的2倍。
(1)写出D元素的原子结构示意图________;E元素在周期表中位置________
(2)C和E两种元素相比较,非金属性较强的是(填元素符号)________,可以验证该结论的是________(填写编号)
A.比较这两种元素的常见单质的沸点 B.比较这两种元素的单质与氢气化合的难易
C.比较这两种元素的气态氢化物的稳定性
(3)写出D的氢氧化物在水中发生酸式电离的电离方程式:________
欲使上述体系中D的简单阳离子浓度增加,可加入的物质是________
(4)B元素与C元素形成的化合物中,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的B的含氧酸盐的化学式是________
高三化学填空题中等难度题查看答案及解析