下列各组离子在指定条件下可能大量共存的是
A. 不能使酚酞试液变红的无色溶液中:Na+、CO32-、K+、ClO-
B. 能与金属铝反应放出氢气的溶液中:K+、NO3-、Cl-、NH4+
C. 常温下水电离出的c(H+)水·c(OH-)水=10-10的溶液中:Na+、Cl-、S2-、SO32-
D. 无色透明溶液:K+、HCO3-、K+、SO42-、Fe3+
【答案】C
【解析】A、不能使酚酞试液变红的无色溶液呈中性或酸性,而CO32-和ClO-水解使溶液呈碱性,不相符,错误;B、能与金属铝反应放出氢气的溶液可以是强酸或强碱溶液,若强酸,则含有硝酸,与铝反应不产生氢气,若强碱,则铵根离子不能大量共存,错误;C、常温下水电离出的c(H+)水·c(OH-)水=10-10的溶液中:水电离出的c(H+)水=c(OH-)水=10-5,是由于S2-和SO32-水解呈碱性引起的,正确;D、无色溶液中不可能含有Fe3+离子,错误。答案选C。
【题型】单选题
【结束】
17
向1 L的密闭容器中加入1 mol X、0.3 mol Z和一定量的Y三种气体。一定条件下发生反应,各物质的浓度随时间变化如图一所示。图二为t2时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。下列说法不正确的是( )
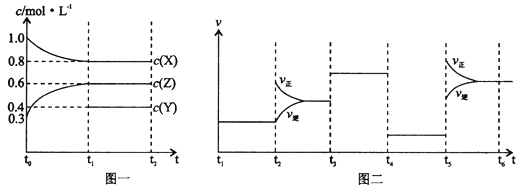
A. Y的起始物质的量为0.5 mol
B. 该反应的化学方程式为:2X(g)+Y(g) 3Z(g) ∆H<0
C. 若t0=0,t1=10 s,则t0~t1阶段的平均反应速率为v(Z)=0.03 mol/(L·s)
D. 反应物X的转化率t6点比t3点高
【答案】B
【解析】试题t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,如t4~t5阶段改变的条件为降低反应温度,平衡移动发生移动,则正逆反应速率不相等,则t4~t5阶段应为减小压强;反应中X的浓度变化为1mol/L-0.8mol/L=0.2mol/L,Z的浓度变化为0.6mol/L-0.3mol/L=0.3mol/L,则X、Z的化学计量数之比为2:3,该反应为气体体积不变的反应,则Y为反应物,该反应为2X(g)+Y(g)3Z(g),t5时为升高温度,平衡正向移动,说明正反应∆H>0。A.X减少0.2mol/L,则Y减少0.1mol/L,则起始Y的浓度为0.1mol/L+0.4mol/L=0.5mol/L,起始物质的量为0.5mol/L×2L=1mol,故A正确;B.由上述分析可知,此温度下该反应的化学方程式为2X(g)+Y(g)
3Z(g)∆H>0,故B错误;C.若t0=0,t1="10" s,则t0~t1阶段的平均反应速率为v(Z)=
=0.03 mol/(L·s),故C正确;D.t3为使用催化剂,平衡不移动,t5时为升高温度,平衡正向移动,反应物X的转化率t6点比t3点高,故D正确;故选B。
考点:考查了化学平衡图像、化学平衡的影响因素的相关知识。
【题型】单选题
【结束】
18
关于过氧化物的叙述正确的是(NA表示阿伏伽德罗常数)( )
A. 7.8g过氧化钠含有的共用电子对数为0.2NA
B. 2H2O2(l)=2H2O(l)+O2(g)ΔH=−98.2 kJ/mol,ΔS=70.5 J/mol·K,该反应低温能自发进行
C. 过氧化氢使高锰酸钾溶液褪色,1mol过氧化氢得到2NA电子
D. 在含有NH4+、Ba2+、Cl—、NO3—离子的溶液 加入少量过氧化钠以上各离子量几乎不减少
高二化学单选题中等难度题