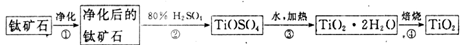-
(1)工业上用钛矿石(主要成分为FeTiO3,主要含FeO、Al2O3、SiO2等杂质)经过以下流程制得TiO2:
其中,步骤II发生的主要反应为:2H2SO4+ FeTiO3=TiOSO4+FeSO4+2H2O
①步骤I发生反应的离了方程式是:_____________、___________。为提高钛矿石的碱浸出速率,步骤I可采取的办法除提高碱的浓度外,还可以采取的办法有_________________、__________________________(写出两种方法)。
②步骤II中加入Fe的目的是___________________;分离出FeSO4晶体的操作是___________。
③步骤III形成的TiO2·nH2O 为胶体,其反应的化学方程式为____________________。
(2)可利用TiO2通过下述两种方法制备金属钛:
方法一: 将TiO2作阴极,石墨作阳极,熔融CaO为电解液,碳块作电解槽池,电解TiO2制得钛,阳极上一定生成的气体是____________,可能生成的气体是__________________。
方法二: 通过以下反应制备金属钛
①TiO2 (s)+2Cl2(g) TiCl4(g)+O2(g) △H=+ 151kJ/mol
TiCl4(g)+O2(g) △H=+ 151kJ/mol
②TiCl4+2Mg 2MgCl2+Ti
2MgCl2+Ti
实际生产中,需在反应①过程中加入碳,可以顺利制得TiCl4。碳的作用除燃烧放热外,还具有的作用是_______________________________________。
-
金属钛被称为“21世纪金属”
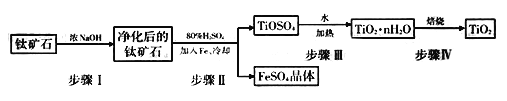
(1)工业上用钛矿石(含FeTiO3,含FeO、Al2O3、SiO2等杂质)经过以下流程制得TiO2:
其中,步骤Ⅱ发生反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H20
①步骤I反生的化学方程式是______________________________若将所得FeSO4晶体溶于水,加热蒸干后所得的固体是_________________
②若步骤Ⅲ中是利用Ti4+在溶液中水解制得TiO2·nH2O,则该反应的离子方程式为_________________________________________________
(2)可利用TiO2通过下述两种方法制备金属钛:
方法一:将TiO2作阴极,石墨作阳极,熔融CaO为电解液,用炭块作电解槽池,电解TiO2制得钛,其阴极发生的反应:______________________________________。
方法二:通过以下反应制备金属钛
①TiO2(s)+2Cl2(g)  TiCl4(g)+O2(g) △H=+151 KJ/mol
TiCl4(g)+O2(g) △H=+151 KJ/mol
②TiCl4+2Mg 2MgCl2+Ti
2MgCl2+Ti
在实际生产中,需在反应①过程中加入碳才能顺利制得TiCl4,其原因是_________________________,______________________________________________。(两方面)
(3)若已知:C(s)+O2(g)=CO2(g) △H=-394 KJ/mol,则由固体TiO2、固体C与Cl2反应制取气态TiCl4的热化学方程式为______________________________________________。
-
TiO2在工业生产和日常生活中有重要用途。
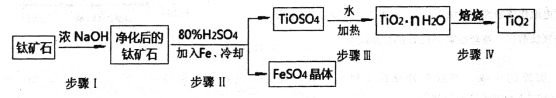
(1)工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
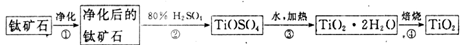
其中,步骤②发生的主要反应为:2H2SO4+FeTiO3 == TOSO4(硫酸氧钛)+FeSO4+2H2O
净化钛矿石时,需用浓氢氧化钠溶液来处理。写出该过程中发生反应的化学方程式:________________。
步骤③中加热的目的是(请写出必要的化学方程式和文字):________。
(2)用TiO2制备金属钛的一种方法是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:TiO2(s)+2Cl2(g) TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。
TiCl4(1)+O2(g) △H=+151 kJ/mol。所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4,请说明判断该反应难以发生的理由是_______。当往氯化反应体系中加入碳后,反应在高温条件下能顺利进行生成TiCl4。
已知:C(s)+O2(g)=CO2(g) △H= 394 kJ/mol。
394 kJ/mol。
则TiO2(s)+C(s)+2Cl2(g)=TiCl4(1)+CO2(g) △H=________
从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因是_______________。
(3)下图是一种染料敏化太阳能电池的示意图。电池的一个由有机光敏染料(S)涂覆TiO2纳米晶体表面制成,另一电极由导电玻璃镀铂构成,电池中发生的反应为:
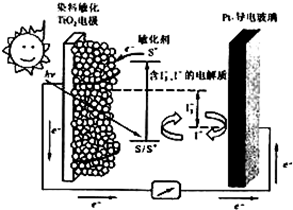
TiO2/S TiO2/S* (激发态)
TiO2/S* (激发态)
TiO2/S*  TiO2/S+ + e-
TiO2/S+ + e-
I3-+2e- 3I-
3I-
2TiO2/S*+I3-  2TiO2/S + I3-
2TiO2/S + I3-
下列关于该电池叙述正确的是________
A.电池工作时,I-离子在镀铂导电玻璃电极上放电
B.电池工作时,是将太阳能转化为电能
C.电池的电解质溶液中I-和I3- 浓度不会减少
D.电池中镀铂导电玻璃为正极
-
TiO2在工业生产和日常生活中有重要用途.
I.工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:

其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O.
(1)净化钛矿石时,是否需要除去杂质FeO?答:______(填“需要”或“不需要”).
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式.
______;______.
II.TiO2可通过下述两种方法制备金属钛:
“方法一”是电解TiO2来获得Ti:将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池.
(3)阴极反应的电极反应式为______.
“方法二”是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti.因下述反应难于发生:
TiO2(s)+2Cl2(g)⇌TiCl4(l)+O2(g)△H=+151kJ•mol-1所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4.当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行.
(4)已知:C(s)+O2(g)=CO2(g);△H=-394kJ•mol-1.
请写出TiO2与Cl2、C反应制各TiCl4的热化学方程式:______.
(5)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因.
-
TiO2在工业生产和日常生活中有重要用途。
I.工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:

其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答:________(填“需要”或“不需要”)。
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式。
答:________。
II.TiO2可通过下述两种方法制备金属钛:
“方法一”是电解TiO2来获得Ti(同时产生O2):将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池。
(3)阴极反应的电极反应式为___________________________________。
(4)电解过程中需定期向电解槽池中加入碳块的原因是______________________。
“方法二”是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:
TiO2 (s)+2Cl2 (g) TiCl4(l)+O2 (g) ΔH=+151 kJ·mol-1
TiCl4(l)+O2 (g) ΔH=+151 kJ·mol-1
所以不能直接由 TiO2 和 Cl2 反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
(5)已知:C(s)+O2 (g) = CO2 (g) ΔH=-394 kJ·mol-1。请填空:
TiO2 (s)+C (s)+2Cl2 (g) = TiCl4 (l)+CO2 (g) ΔH= ______________
(6)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因。
答:____________________________________________。
-
TiO2在工业生产和日常生活中有重要用途。
I.工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:

其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答:________(填“需要”或“不需要”)。
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式。
答:; ________。
II.TiO2可通过下述两种方法制备金属钛:
“方法一”是电解TiO2来获得Ti:将处理过的TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池。
(3)阴极反应的电极反应式为___________________________________。
“方法二”是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:TiO2 (s)+2Cl2 (g)  TiCl4(l)+O2 (g) ΔH=+151 kJ·mol-1所以不能直接由 TiO2 和 Cl2 反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
TiCl4(l)+O2 (g) ΔH=+151 kJ·mol-1所以不能直接由 TiO2 和 Cl2 反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
(4)已知:C(s)+O2 (g) = CO2 (g) ; ΔH=-394 kJ·mol-1。请填空:
TiO2 (s)+C (s)+2Cl2 (g) = TiCl4 (l)+CO2 (g); ΔH= ______________
(5)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因。
答:____________________________________________。
-
TiO2在工业生产和日常生活中有重要用途。
I、工业上用钛铁矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:

其中,步骤③发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)写出钛元素在周期表中的位置______________。
净化钛矿石时,是否需要除去杂质FeO?____ ________(填“需要”或“不需要”)
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中两性氧化物发生反应的离子反应方程式:____________________。
(3)④中加入的X可能是( )
A.H2O2 B.KMnO4 C.KOH D.SO2
(4)④⑤两步的目的是___________________________。
(5)写出⑥的化学反应方程式_____________________。
II、TiO2可通过下述两种方法制备金属钛:方法一是电解TiO2来获得Ti(同时产生O2):
将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池。
(6)阴极反应的电极反应式为_____________________。
(7)电解过程中需定期向电解槽池中加入碳块的原因是__________________。
方法二是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:
TiO2 (s) +2Cl2 (g) TiCl4(1)+O2 (g) △H= +151 kJ/mol
TiCl4(1)+O2 (g) △H= +151 kJ/mol
所以不能直接由TiO2和Cl2反应(即氯化反应)来制取TiCl4。请从反应原理角度说明该反应难进行的原因__________________。
-
TiO2在工业生产和日常生活中有重要用途。
I.工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:

其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答:________(填“需要”或“不需要”)。
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式。
答:________。
II.TiO2可通过下述两种方法制备金属钛:
“方法一”是电解TiO2来获得Ti(同时产生O2):将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池。
(3)阴极反应的电极反应式为___________________________________。
(4)电解过程中需定期向电解槽池中加入碳块的原因是______________________。
“方法二”是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:
TiO2 (s)+2Cl2 (g) TiCl4(l)+O2 (g) ΔH=+151 kJ·mol-1
TiCl4(l)+O2 (g) ΔH=+151 kJ·mol-1
所以不能直接由 TiO2 和 Cl2 反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
(5)已知:C(s)+O2 (g) = CO2 (g) ΔH=-394 kJ·mol-1。请填空:
TiO2 (s)+C (s)+2Cl2 (g) = TiCl4 (l)+CO2 (g) ΔH= ______________
(6)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因。
答:____________________________________________。
-
(15分).钛白粉(主要成分是TiO2),广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。工业上常以钛矿石(主要成分为FeTiO3(钛酸亚铁),并含FeO、A12O3、 SiO2等杂质)为主要原料经过以下流程制得TiO2,并获得副产品FeSO4·7H2O.
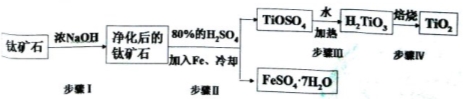
请回答下列问题:
(l)步骤I的目的是
(2)写出步骤Ⅱ中FeTiO3与H2SO4反应的化学方程式 。
(3)步骤II中经过 、 、过滤、洗涤等操作可以得到FeSO4·7H2O.晶体,还可以利用酸化的FeSO4溶液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水).该反应的离子方程式为
(4)请结合化学用语用化学平衡理论解释步骤III中将TiOSO4转化为H2TiO3的原理:
(5)为测定步骤II后溶液中TiOSO4的含量,首先取待测钛液10 mL加水稀释至100 mL,再加过量铝粉,充分振荡,使其完全反应:3TiO2++Al+6H+=3Ti3++Al3++3H2O。过滤后,取出滤液20.00 mL,以KSCN溶液为指示剂,用0.1000 mol·L-1 NH4Fe(SO4)2溶液滴定至终点,再重复2次,测得平均值为30.00mL。
①该滴定达到终点时的现象
②待测钛液中TiOSO4的物质的量浓度是 。
-
(11分)钛是一种重要的金属,工业上用钛铁矿(主要成分为FeTiO3 ,含FeO、Al2O3、SiO2 等杂质)为原料制钛白粉(TIO2 ) , TiO2常通过两种方法可制得 Ti。
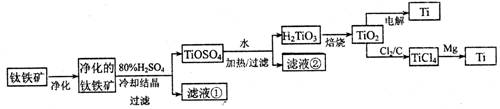
其中, 2H2SO4+ FeTiO3 = TiOSO4+ FeSO4+ 2H2O 。回答下列问题。
(l)净化钛矿石时,需用浓氢氧化钠溶液来处理,该过程中发生反应的化学方程式有:
SiO2+2NaOH =Na2SiO3 + H2O 和________
(2)滤液①中的溶质主要是 FeSO4,检验其中Fe2+的方法是:________.
(3)从 TiOSO4→H2TiO3需要加热,则加热的目的是:________。
(4)电解 TiO2来获得 Ti 是以 TiO2作阴极,石墨为阳极,熔融CaO为电解液,用碳块作电解槽池。其阴极反应的电极反应式为:________.
(5)从化学平衡的角度解释:往TiO2和Cl2反应体系中加人焦炭后,能使反应 TIO2(s) + 2C12 (g) TICl4(l) +O2 (g)顺利进行的原因是:________
TICl4(l) +O2 (g)顺利进行的原因是:________

TiCl4(g)+O2(g) △H=+ 151kJ/mol
2MgCl2+Ti