-
(16分)化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和
溶解平衡等四种,且均符合勒夏特列原理。请回答下列问题:
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g)  4C(g) △H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)
4C(g) △H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)
=4mol/L。试确定B的起始浓度c(B)的取值范围是________;若改变
条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是________。
①增加C的物质的量②加压 ③升温④使用催化剂
(2)反应C(s)+CO (g)
(g)  2CO(g)平衡常数K的表达式为________;
2CO(g)平衡常数K的表达式为________;
已知C(s)+H 0(g)t
0(g)t CO(g)+H
CO(g)+H (g)的平衡常数为K1;H
(g)的平衡常数为K1;H (g)+CO
(g)+CO (g)
(g)  C0(g)
C0(g)
+H 0(g)的平衡常数为恐,则K
0(g)的平衡常数为恐,则K 与K
与K 、K
、K 二者的关系为________。
二者的关系为________。
(3)已知某温度下,反应2SO +0
+0
 2S0
2S0 的平衡常数K=19。在该温度下的体积
的平衡常数K=19。在该温度下的体积
固定的密闭容器中,co(SO )=lmol·L
)=lmol·L c0(O
c0(O )=1mol·L
)=1mol·L ,当反应在该温度下SO
,当反应在该温度下SO 转化率
转化率
为80%时,该反应 (填“是”或“否”)达到化学平衡状态,若未达到,向________
(填“正反应”或“逆反应”)方向进行。
(4)对于可逆反应:aA(g)+bB(g)  cC(g)+riD(g)△H=
cC(g)+riD(g)△H= kJ·mol
kJ·mol ;若
;若 +b>
+b>
c+d,增大压强平衡向________ (填“正反应”或“逆反应”)方向移动;若升高温度,平衡向
逆反应方向移动,则 ________0(填“>”或“<”)。
________0(填“>”或“<”)。
-
(12分)化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种。且均符合勒夏特列原理。请回答下列问题。
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应A(g)+2B(g) 4C(g)  H >0 达到平衡时,c(A)=2mol/L, c(B)=7mol/L, c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是________;若改变条件重新达到平衡后,体系中C的质量分数增大,下列措施可行的是________
H >0 达到平衡时,c(A)=2mol/L, c(B)=7mol/L, c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是________;若改变条件重新达到平衡后,体系中C的质量分数增大,下列措施可行的是________
A、增加C的物质的量 B、加压 C、升温 D、使用催化剂
(2)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色。分析该溶液遇酚酞呈红色原因(用离子方程式表示)
(3) 在AgCl饱和溶液中尚有AgCl固体存在,当向溶液中加入0.1 mol·L-1的盐酸时,溶液中
c(Ag+)________(选填“变大”、“变小”、“不变”)
-
(8分)化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种。且均符合勒夏特列原理。请回答下列问题。
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g)  4C(g)
4C(g)  H >0 达到平衡时,c(A)=2mol/L, c(B)=7mol/L, c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是________;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是________
H >0 达到平衡时,c(A)=2mol/L, c(B)=7mol/L, c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是________;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是________
①增加C的物质的量 ②加 压 ③升 温 ④使用催化剂
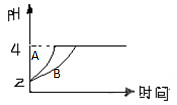
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化 如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”)。设盐酸中加入的Zn质量为m1, 醋酸溶液中加入的Zn质量为m2。则m1________m 2(选填“<”、“=”、“>”)
-
(8分)化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种。且均符合勒夏特列原理。请回答下列问题。
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g)  4C(g)
4C(g)  H >0 达到平衡时,c(A)=2mol/L, c(B)=7mol/L, c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是________;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是________
H >0 达到平衡时,c(A)=2mol/L, c(B)=7mol/L, c(C)=4mol/L。试确定B的起始浓度c(B)的取值范围是________;若改变条件重新达到平衡后体系中C的体积分数增大,下列措施可行的是________
①增加C的物质的量 ②加 压 ③升 温 ④使用催化剂
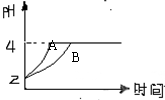
(2)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”)。设盐酸中加入的Zn质量为m1, 醋酸溶液中加入的Zn质量为m2。则m1________m2(选填“<”、“=”、“>”)
-
化学学科中的平衡理论主要包括: 化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
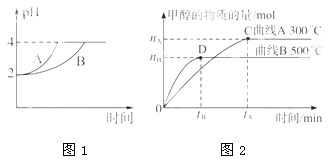
(1)在体积为3L 的密闭容器中,CO 与H2 在一定条件下反应生成甲醇(图2):CO(g)+2H2(g) CH3OH(g)。升高温度,K值____(填“增大”、“减小”或“不变”)。
CH3OH(g)。升高温度,K值____(填“增大”、“减小”或“不变”)。
(2) 常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH 变化如图1所示。则表示醋酸溶液pH 变化的曲线是_______ (填“A”或“B”)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1____m2 (选填“<”、“=”、“>”)。
(3)生活中明矾常作净水剂,其净水的原理是_______ (用离子方程式表示)。
(4)含Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L 的Cr2O72-。为了使废水的排放达标,进行如下处理:

常温下若处理后的废水中c(Cr3+)=6.0×10-7mol/L,则处理后的废水的pH=_______。{Ksp[Cr(OH) 3] =6.0×10-31}
-
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理.请回答下列问题:
(1)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示.则图中表示醋酸溶液中pH变化曲线的是________(填”A”或”B”).设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2.则m1________m2.(选填”<“、”=“或”>“)
(2)在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO(g)+2H2(g)⇌CH3OH(g).该反应的平衡常数表达式K=________,升高温度,K值________(填”增大”“减小”或”不变”).在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=________.
(3)难溶电解质在水溶液中存在着溶解平衡.在某温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数.例如:Mg(OH)2(s)⇌Mg2+ (aq)+2OH- (aq),某温度下Ksp=c(Mg2+)[c(OH-)]2=2×10-11.若该温度下某MgSO4溶液里c(Mg2+)=0.002mol•L-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于________;该温度下,在0.20L的0.002mol•L-1MgSO4溶液中加入等体积的0.10mol•L-1的氨水溶液,该温度下电离常数K ,经计算________(填”有”或”无”)Mg(OH)2沉淀生成.
,经计算________(填”有”或”无”)Mg(OH)2沉淀生成.
(4)常温下,向某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈________性.在分析该溶液遇酚酞呈红色的原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH所致;乙同学认为是溶液中Na2CO3电离出的 水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论).
水解所致.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论).
-
回答下列问题
学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理请回答下列问题:
(1)常温下,某纯碱溶液中滴入酚酞,溶液呈红色,则该溶液呈 ______性,原因是________________;用离子方程式表示
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于 ______________;
(3)已知在H2S溶液中存在下列平衡: H2S H++HS-
H++HS-
向H2S溶液中加入NaOH固体时,不考虑温度变化电离平衡向______移动,填“左”或“右”),c(H+)______。(填“增大”、“减小”或“不变”
向H2S溶液中加入NaHS固体时,电离平衡向______移动,填“左”或“右”)c(S2—)______。(填“增大”、“减小”或“不变”)
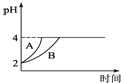
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 ______ 填“A”或“B”;设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1______ m2。 (选填“ ”、“
”、“ ”、“
”、“ ”
”
-
回答下列问题
学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理请回答下列问题:
(1)常温下,某纯碱溶液中滴入酚酞,溶液呈红色,则该溶液呈 ______性,原因是________________;用离子方程式表示
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于 ______________;
(3)已知在H2S溶液中存在下列平衡: H2S H++HS-
H++HS-
向H2S溶液中加入NaOH固体时,不考虑温度变化电离平衡向______移动,填“左”或“右”),c(H+)______。(填“增大”、“减小”或“不变”
向H2S溶液中加入NaHS固体时,电离平衡向______移动,填“左”或“右”)c(S2—)______。(填“增大”、“减小”或“不变”)
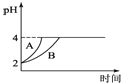
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是 ______ 填“A”或“B”;设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2,则m1______ m2。 (选填“ ”、“
”、“ ”、“
”、“ ”
”
-
本题为《化学反应原理(选修4)》选做题。
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈_____性,原因是___________;(用离子方程式表示)
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于___________;
(3)已知在H2S溶液中存在下列平衡:H2S HS-+H+
HS-+H+
①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向______移动,(填“左”或“右”)c(H+)_________。(填“增大”、“减小”或“不变”)
②向H2S溶液中加入NaHS固体时,电离平衡向______移动,(填“左”或“右”)c(S2-)_________。(填“增大”、“减小”或“不变”)
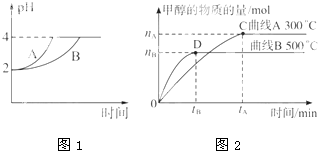
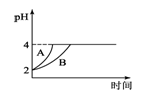
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”);
(5)难溶电解质在水溶液中存在溶解平衡。某MgSO4溶液里c(Mg2+)=0.002mol•L-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于________;(该温度下Mg(OH)2的Ksp=2×10-11)
-
本题为《化学反应原理(选修4)》选做题。
化学学科中的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1)常温下,某纯碱(Na2CO3)溶液中滴入酚酞,溶液呈红色,则该溶液呈_____性,原因是___________;(用离子方程式表示)
(2)在常温下将pH=2的盐酸10mL加水稀释到1L,则稀释后的溶液的pH值等于___________;
(3)已知在H2S溶液中存在下列平衡:H2S HS-+H+
HS-+H+
①向H2S溶液中加入NaOH固体时,(不考虑温度变化)电离平衡向______移动,(填“左”或“右”)c(H+)_________。(填“增大”、“减小”或“不变”)
②向H2S溶液中加入NaHS固体时,电离平衡向______移动,(填“左”或“右”)c(S2-)_________。(填“增大”、“减小”或“不变”)
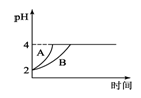
(4)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图1所示.则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”);
(5)难溶电解质在水溶液中存在溶解平衡。某MgSO4溶液里c(Mg2+)=0.002mol•L-1,如果生成Mg(OH)2沉淀,应调整溶液pH,使之大于________;(该温度下Mg(OH)2的Ksp=2×10-11)
4C(g) △H>0达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(c)
(g)
2CO(g)平衡常数K的表达式为________;
0(g)t
CO(g)+H
(g)的平衡常数为K1;H
(g)+CO
(g)
C0(g)
0(g)的平衡常数为恐,则K
与K
、K
二者的关系为________。
+0
2S0
的平衡常数K=19。在该温度下的体积
)=lmol·L
c0(O
)=1mol·L
,当反应在该温度下SO
转化率
cC(g)+riD(g)△H=
kJ·mol
;若
+b>
________0(填“>”或“<”)。








